题目内容
12.运用原电池原理设计实验,验证Fe3+与Cu2+氧化性强弱.(1)请画出原电池装置图.
(2)写出原电池正极的电极反应式Fe3++e-═Fe2+.
(3)若电路中转移了0.1mol 电子,则该原电池负极质量减轻了3.2g.
分析 验证Fe3+与Cu2+氧化性强弱,发生2Fe3++Cu=2Fe2++Cu2+,Cu为负极,选择石墨作正极,正极上铁离子得到电子,以此来解答.
解答 解:(1)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,正极可为碳棒,电解质溶液为氯化铁,则原电池装置图可设计为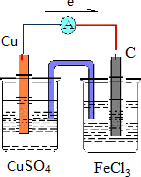 ,电子从铜极流向碳极,
,电子从铜极流向碳极,
故答案为: ;
;
(2)正极反应式为Fe3++e-═Fe2+,故答案为:Fe3++e-═Fe2+;
(3)由Cu-2e-=Cu2+可知,电路中转移了0.1mol 电子,则该原电池负极质量减轻了0.1mol×$\frac{1}{2}$×64g/mol=3.2g,故答案为:3.2.
点评 本题考查原电池的设计,为高频考点,把握发生的电极反应、原电池工作原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.下列离子方程式的书写正确的是( )
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 将Na投入到CuSO4溶液:2Na+Cu2+═2Na++Cu | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O |
3.常温下,将CO2缓慢通入一定体积的NaOH溶液中,溶液的pH随通入CO2(标准状况)的变化曲线如图所示(忽略CO2的溶解),则下列说法中正确的是( )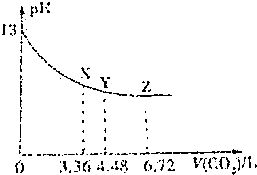

| A. | 该NaOH溶液的浓度为0.1mol/L,体积为6L | |
| B. | X、Y、Z三点对应的溶液中离子的种类不同 | |
| C. | Y点对应的融资中离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| D. | Y点对应的溶液中存在着:c(Na+)=2c(HCO3-)+c(OH-) |
7.对于可逆反应:N2(g)+3H2(g)?2NH3(g).下列判断不正确的是( )
| A. | 20s内,H2的浓度改变0.60mol/L,表明该反应达到平衡状态 | |
| B. | 当气体总压强不随时间改变时,表明该反应达到平衡状态 | |
| C. | 使用催化剂会影响达到平衡的时间 | |
| D. | 达到化学平衡状态时,正、逆反应速率都为0且不再发生变化 |
4.E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)?G(g),已知该反应的平衡常数值如下表所示.下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)>v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大 |
1.下列叙述正确的是( )
| A. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 | |
| D. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
