题目内容
20.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2+9H2O,在反应中还原产物与氧化产物的质量之比为( )| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
分析 该反应中N元素化合价由-3价、+5价变为0价,则氮气既是氧化产物也是还原产物,转移电子个数是15,根据转移电子守恒知,生成的氮气中有$\frac{5}{8}$的是氧化产物,有$\frac{3}{8}$的是还原产物,据此分析解答.
解答 解:该反应中N元素化合价由-3价、+5价变为0价,则氮气既是氧化产物也是还原产物,转移电子个数是15,根据转移电子守恒知,生成的氮气中有$\frac{5}{8}$的是氧化产物,有$\frac{3}{8}$的是还原产物,所以还原产物与氧化产物的质量之比为$\frac{3}{8}$:$\frac{5}{8}$=3:5,故选D.
点评 本题以氧化还原反应为载体考查化学方程式有关计算,为高频考点,明确氮气中氧化产物与还原产物所占比例是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.铁、铜混合粉末18.0g加入到100mL 5.0mol•L-1FeCl3溶液中,充分反应后,剩余固体质量为2.8g.下列说法正确的是( )
| A. | 剩余固体是铜 | |
| B. | 原固体混合物中铜的质量是9.6g | |
| C. | 反应后溶液中n(Fe3+)=0.10mol | |
| D. | 反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
15.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
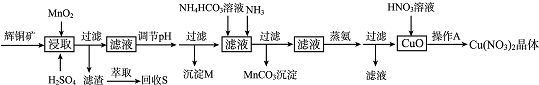
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.
5.下列离子方程式的书写正确的是( )
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 将Na投入到CuSO4溶液:2Na+Cu2+═2Na++Cu | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O |
12.下列叙述正确的是( )
| A. | Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | K2S溶液中:2c(K+)═c(H2S)+c(S2-)+c(HS-) | |
| D. | 相同浓度的CH3COOH和NaOH溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)═c(Na+) |
9.下列关于仪器使用的说法正确的是( )
| A. | 配制一定物质的量浓度的溶液时应先用清水润洗容量瓶 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 振荡分液漏斗时应关闭其玻璃塞和活塞 |
7.对于可逆反应:N2(g)+3H2(g)?2NH3(g).下列判断不正确的是( )
| A. | 20s内,H2的浓度改变0.60mol/L,表明该反应达到平衡状态 | |
| B. | 当气体总压强不随时间改变时,表明该反应达到平衡状态 | |
| C. | 使用催化剂会影响达到平衡的时间 | |
| D. | 达到化学平衡状态时,正、逆反应速率都为0且不再发生变化 |

 10HCl□
10HCl□