题目内容
用相关方程式或理论解释下列现象
(1)FeCl3净水原理:
(2)纯碱溶液中滴加酚酞显红色: .
(1)FeCl3净水原理:
(2)纯碱溶液中滴加酚酞显红色:
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)FeCl3水解生成Fe(OH)3胶体,胶体具有吸附性而净水;
(2)Na2CO3为强碱弱酸盐,碳酸根离子水解生成氢氧根离子而使溶液呈碱性.
(2)Na2CO3为强碱弱酸盐,碳酸根离子水解生成氢氧根离子而使溶液呈碱性.
解答:
解:(1)FeCl3水解生成Fe(OH)3胶体,水解方程式为FeCl3+3H2O?Fe(OH)3(胶体)+3HCl Na2CO3+H2O=NaHCO3+NaOH,胶体能吸附水中的悬浮物而净水,
故答案为:FeCl3+3H2O?Fe(OH)3(胶体)+3HCl;
(2)Na2CO3为强碱弱酸盐,碳酸根离子水解生成氢氧根离子而使溶液呈碱性,水解方程式为Na2CO3+H2O?NaHCO3+NaOH,无色酚酞试液遇碱变红色,所以碳酸钠溶液呈红色,故答案为:Na2CO3+H2O?NaHCO3+NaOH.
故答案为:FeCl3+3H2O?Fe(OH)3(胶体)+3HCl;
(2)Na2CO3为强碱弱酸盐,碳酸根离子水解生成氢氧根离子而使溶液呈碱性,水解方程式为Na2CO3+H2O?NaHCO3+NaOH,无色酚酞试液遇碱变红色,所以碳酸钠溶液呈红色,故答案为:Na2CO3+H2O?NaHCO3+NaOH.
点评:本题考查了盐类水解,明确盐的性质确定盐溶液酸碱性,注意多元弱酸根离子和多元弱碱离子水解区别,知道胶体净水与次氯酸盐杀菌消毒的区别,题目难度不大.

练习册系列答案
相关题目
下列各组反应中,前者属于取代反应,后者则属于加成反应的是( )
| A、乙酸、乙醇和浓H2SO4混合共热;乙醛和Cu(OH)2悬浊液共热 |
| B、乙醇和浓H2SO4加热到170℃;乙醇与灼热的铜反应 |
| C、苯酚溶液中滴加溴水;乙烯通入溴水 |
| D、苯和氢气在镍催化下加热反应;苯和液溴、铁粉混合 |
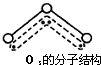 ,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
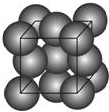 金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.