题目内容
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g),若经2s(秒)后测得C 的浓度为0.6mol?L-1,则:
①用物质A表示的反应的平均速率
②2s时物质B的浓度为 .
①用物质A表示的反应的平均速率
②2s时物质B的浓度为
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
根据概念计算A的速率和B的浓度.
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
根据概念计算A的速率和B的浓度.
解答:
解:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
①用物质A表示2 s内的平均反应速率=
=0.3 mol/(L?s),故答案为:0.3 mol/(L?s);
②2 s后物质B的浓度=
=0.7mol/L,故答案为:0.7mol/L;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
①用物质A表示2 s内的平均反应速率=
| 1.2mol | ||
|
②2 s后物质B的浓度=
| 1.4mol |
| 2L |
点评:本题考查化学反应的基本计算,理解反应速率、浓度概念和计算应用是关键,题目较简单.

练习册系列答案
相关题目
下列四组物质中,前者属于电解质,后者属于非电解质的是( )
| A、氯化钠、碳酸钠 |
| B、铜、二氧化硫 |
| C、硫酸铜 蔗糖 |
| D、乙醇 氢氧化钠 |
为维持生命活动,人需要不断地补充能量.下列物质中不能为人补充能量的是( )
| A、水 | B、糖类 | C、油脂 | D、蛋白质 |
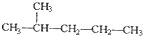 和
和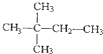 ②
② 和
和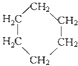
 ④C2H6和
④C2H6和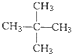 ⑤
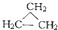
⑤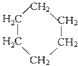 和
和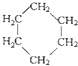

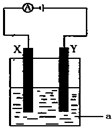 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是