题目内容
4.6g Na与足量的水反应,生成的NaOH的物质的量是多少?生成的气体的体积在标准状况下的体积是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算4.6g钠的物质的量,根据2Na+2H2O=2NaOH+H2↑计算生成氢氧化钠、氢气的物质的量,再根据V=nVm计算氢气的体积.
| m |
| M |
解答:
解:4.6gNa的物质的量=
=0.2mol,
2Na+2H2O=2NaOH+H2↑
2 2 1
0.2mol n(NaOH) n(H2)
n(NaOH)=
=0.2mol,
n(H2)=
=0.1mol,故标况下生成V(H2)=0.1mol×22.4L/mol=2.24L,
答:生成的NaOH的物质的量是0.2mol,生成的气体的体积在标准状况下是2.24L.
| 4.6g |
| 23g/mol |
2Na+2H2O=2NaOH+H2↑
2 2 1
0.2mol n(NaOH) n(H2)
n(NaOH)=
| 0.2mol×2 |
| 2 |
n(H2)=
| 0.2mol×1 |
| 2 |
答:生成的NaOH的物质的量是0.2mol,生成的气体的体积在标准状况下是2.24L.
点评:本题考查化学方程式的计算,比较基础,注意反应方程式的书写,有利于基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
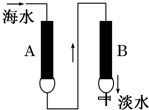 海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )
海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )| A、HR与镁离子的反应可表示为:2HR+Mg2+═MgR2+2H+ |
| B、ROH与氯离子的反应可表示为:ROH+Cl-═RCl+OH- |
| C、A为氢型离子交换树脂(HR),B为羟型离子交换树脂(ROH) |
| D、A为羟型离子交换树脂(ROH),B为氢型离子交换树脂(HR) |

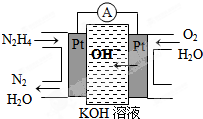


 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是