题目内容
20.氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:I(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵.
①写出磷酸主要的电离方程式H3PO4?H2PO4-+H+.
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnQx=3n+1(用n表示).
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式.
□H2PO2-+□Ag++□6OH-=□PO43-+□Ag++□4H2O
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

①除砷过程在75℃下进行,其合理的原因是cd(填字母).
a.使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越少(填“多”或“少”).
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低.
II(4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]=$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10-10.计算得到可逆反应AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.6×10-3 (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl0.04mol(保留1位有效数字).
分析 (1)①磷酸属于弱电解质,第一步电离为主;
②根据化合价代数和为0计算;
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,结合电荷守恒、原子守恒配平;
(3)①白磷不溶于水,熔化不能改变其毒性,提高温度可以加快反应速率,但温度过高,硝酸会分解;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷;
(4)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),故该反应平衡时为前两者平衡常数之积;
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,结合平衡常数计算解答.
解答 解:(1)①磷酸属于弱电解质,第一步电离为主,磷酸主要的电离方程式:H3PO4?H2PO4-+H+,
故答案为:H3PO4?H2PO4-+H+;
②根据化合价代数和为0,则(n+2)+5n-2x=0,故x=3n+1,
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,平衡后方程式为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O,
故答案为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O;
(3)①a.白磷不溶于水,故a错误;
b.熔化不能改变其毒性,故b错误;
c.温度过高,硝酸会分解,需要控制合适的温度,故c正确;
d.提高温度可以加快反应速率,故d正确.
故选:cd,
故答案为:cd;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少,
故答案为:少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低,
故答案为:硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低;
(4)Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)的平衡常数的表达式K=$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$,
Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=$\frac{c([Ag(N{H}_{3})_{2}]^{+})c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故$\frac{{x}^{2}}{(1-2x)^{2}}$
=1.6×10-3,解得x=0.04,
故答案为:$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;1.6×10-3;0.04.
点评 本题考查物质制备工艺流程、氧化还原反应配平、平衡常数有关计算、电离方程式书写等,属于拼合型题目,侧重考查学生分析计算能力、知识迁移运用能力.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
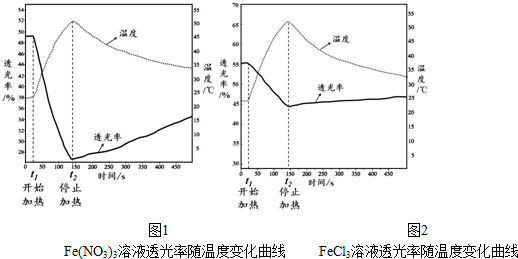
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).

(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).
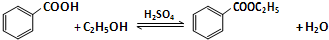
已知:
| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:
①乙醇、乙酸和浓硫酸混合的先后顺序先加乙醇,再加浓硫酸,等冷却再加乙酸;
②浓硫酸的作用是催化剂和吸水剂;
③实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,请写出发生该变化的离子反应方程式CH3COOH+CO32-=CH3COO-+HCO3-;
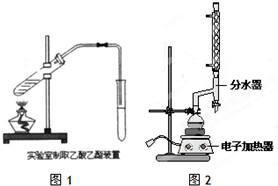
(2)按照图2所示装置制备苯甲酸乙酯.
①制备:在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,其中分水器的作用是分离出反应生成的水,控制温度加热回流2h.
a.实验中使用分水器不断分离除去水的目的是分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.从提供的分析实验室制取苯甲酸乙酯为什么不使用制取乙酸乙酯一样的装置?如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
②产品的提纯
将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入Na2CO3溶液呈中性;用分液漏斗分出有机层得粗产品.水层用25mL乙醚萃取分液,醚层与粗产品合并;在粗产品加入无水氯化钙后,静置、过滤,过滤液进行蒸馏,蒸出乙醚后,继续升温,接收210~213℃的馏分;产品经检验合格,测得产品体积为6mL.
c.在该实验分液过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”可“下口倒出”);
d.该实验中苯甲酸乙酯的产率为42%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现白烟生成,产生该现象的原因在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(1)工业上可用纯碱、焦炭、氨气在高温下反应可以制取NaCN,写出反应的化学方程式Na2CO3+C+2NH3=2NaCN+3H2O.
(2)工业利用NaCN制备蓝色染料的流程如下:
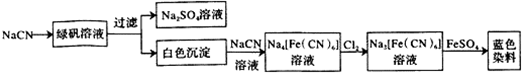
通入Cl2时发生反应的离子方程式为_2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-_,该蓝色染料的化学式为Fe3[Fe(CN)6]2.
(3)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.浸取过程的氧化剂是O2.
(4)上述方法的主要缺点是容易引起水体污染.天津“8.12“爆炸中扩散的CN-也造成了部分水体污染.某小组欲检测污水中CN-的浓度.
资料:碱性条件下发生离子反应:2CN-+5H2O2+2OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
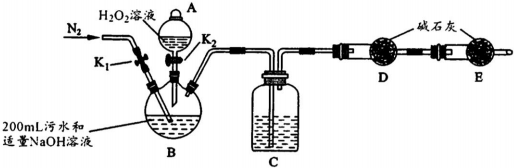
①加入药品之前的操作是检查装置气密性;B的名称是三颈瓶,C中试剂是浓H2S04.
②实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
(5)常温下HCN的电离常数Ka=6.2×10-10,浓度均为0.5mol/L的NaCN和HCN的混合溶液显碱(填“酸”、“碱”或“中”)性,通过计算说明其原因Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性.
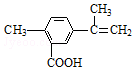
| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
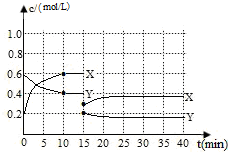 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化