题目内容
9.NH3的催化氧化是工业合成硝酸的基础,某实验小组在实验室中对该反应进行了探究.回答下列问题:(1)气体制备
备选试剂:KClO3、MnO2、Na2CO3、NaHCO3、Na2O2、H2O2、NH4HCO3、NaOH、溶液、无水氯化钙、浓硫酸、碱石灰等.
1小组采用装置甲制备于燥纯净的NH3(收集装置已略去,下同),且反应后试管中无固体剩余,则试管中选取如图甲的试剂是NH4HCO3,仪器B的名称是干燥管,该装置中选取的试剂是碱石灰.
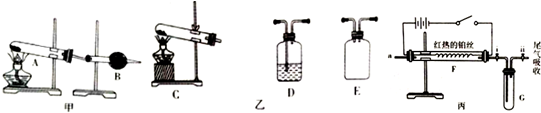
②该小组采用KClO3制备纯净的O2,通过查阅资料,发现该方法制备的O2中含有Cl2杂质.图乙是该小组制备纯净O2时可能用到的装置.装置连接顺序为C→E→D→D(或D→D)(部分仪器可重复使用),其中除去Cl2反应的化学方程式为Cl2+2NaOH=NaCI+NaCIO+H2O.
(2)氨的催化氧化,打开图丙中活塞i和活赛ii,将(1)中制备的纯净NH3、O2(O2过量)经a管口通入到F装置中,打开电源,观察现象.
待铂丝为红热状态,关闭电源铂丝①持续呈红热状态,G中试管内②产生红棕色气体.③生成白烟
关闭活塞i和活塞ii,取下装置G,将该装置置于冷水中G中试管内④气体颜色变浅⑤有液态物质生成.
分析 (1)①根据各物质的状态和性质来分析确定;
②收集干燥的纯净的氧气,所以要先制取,除Cl2,再干燥,最后收集;
(2)NH3的催化氧化反应是一个放热反应,生成NO被氧化成红棕色NO2;
解答 解:(1)①加热NH4HCO3时,碳酸氢铵分解生成氨气、水和二氧化碳,用盛碱石灰的干燥管除去水和二氧化碳就可以得到氨气;
故答案为:NH4HCO3;干燥管;碱石灰;
②C装置是用来制取氧气的装置,用NaOH溶液除Cl2,由于浓硫酸具有吸水性,可以用来干燥气体,所以再通过浓硫酸把氧气干燥后再进行收集,由于要收集干燥的氧气,根据密度比空气大,用向上排空气法收集,所以仪器的连接顺序为E→D→D;
故答案为:E→D→D(或D→D);Cl2+2NaOH=NaCI+NaCIO+H2O;
(2)①NH3的催化氧化反应是一个放热反应,
故答案为:持续呈红热状态;
②NO被氧化成红棕色NO2,
故答案为:产生红棕色气体;
③NH3与HNO3反应生成NH4Cl白烟,
故答案为:生成白烟;
④NO2遇冷变无色的N2O4,
故答案为:气体颜色变浅;
⑤温度降低,部分NO2转化为N2O4,
故答案为:有液态物质生成.
点评 本题考查了氨气的实验室制备及性质的检验,明确制备原理和装置选择方法是解题关键,注意氨气的收集及检验的方法,题目难度中等.

练习册系列答案
相关题目
17. 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$\stackrel{60℃-80℃}{→}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置.在实验开始时温度计水银球的位置应在试管A的反应液中,目的是控制反应温度为60℃~80℃;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在在试管A的支管口处.
(3)烧杯B内盛装的液体可以是甘油(写出一种即可).
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是ab.(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液.
 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$\stackrel{60℃-80℃}{→}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置.在实验开始时温度计水银球的位置应在试管A的反应液中,目的是控制反应温度为60℃~80℃;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在在试管A的支管口处.
(3)烧杯B内盛装的液体可以是甘油(写出一种即可).
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是ab.(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液.
4.下列说法正确的是( )
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
18.下列说法中正确的是( )
| A. | 1mol水的质量为18g/mol | |
| B. | 标准状况下,3.01×1023个CO2分子的质量为22g | |
| C. | 标准状况下,1mol任何物质体积约为22.4 L | |
| D. | 二氧化硫的摩尔质量是64 g |
19.下列说法不正确的是( )
| A. | 丁达尔效应可用于鉴别胶体和溶液 | |
| B. | 胶体粒子的直径在1~100 nm之间 | |
| C. | 胶体一定是混合物 | |
| D. | 将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体 |

 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: