题目内容
8.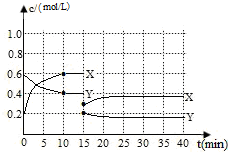 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化(1)前10min内用NO2表示反应的平均速率v (NO2)=0.04mol/(L•min);
上述反应的平衡常数K=1.1.
(2)下列能说明反应达到平衡状态的是AB
A.体系的颜色不再改变 B.混合气体的压强不再改变
C.混合气体的密度不再改变 D.2v (NO2)=v(N2O4)
(3)反应进行到15min时,曲线发生变化的原因是增大容器体积.
(4)若要使上述反应的平衡常数增大,可采取的措施是C
A.加入催化剂 B.缩小容器容积
C.降低温度 D.再加入一定量的NO2.
分析 (1)由图象可知达到10min时X的物质的量浓度变化为0.2,Y变化为0.1.则X为NO2,Y为N2O4,发生N2O4(g)?2NO2(g)△H>0,结合平衡浓度计算;
(2)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,含量不变;
(3)反应进行至15min时,反应物和生成物浓度都减少,说明容器体积增大
(4)化学平衡常数只与温度有关.
解答 解:(1)根据图象中物质浓度变化知,反应物是四氧化二氮、生成物是二氧化氮,v(NO2)=$\frac{0.6mol/L-0.2mol/L}{10min}$=0.04mol/(L•min),
由图象可知达到10min时X的物质的量浓度变化为0.2,Y变化为0.1.则X为NO2,Y为N2O4,发生N2O4(g)?2NO2(g)△H>0,
平衡时c(NO2)=0.8mol/L,c(N2O4)=0.6mol/L,平衡常数K=$\frac{0.{8}^{2}}{0.6}$=1.1,
故答案为:0.04;1.1;
(2)A.体系的颜色不再改变,说明浓度不变,可说明达到平衡状态,故A正确;
B.反应前后体积不等,混合气体的压强不再改变,可说明达到平衡状态,故B正确;
C.因体积、质量不变,则混合气体的密度不再改变不能说明达到平衡状态,故C错误;
D.2v (NO2)=v(N2O4),不能说明正逆反应速率相等,故D错误.
故答案为:A B;
(3)反应进行至15min时,反应物和生成物浓度都减少,说明容器体积增大,故答案为:增大容器体积;
(4)化学平衡常数只与温度有关,所以要改变平衡常数自由改变温度,故答案为:C.
点评 本题考查了化学平衡的有关计算,为高考常见题型,侧重考查学生的分析、计算能力,会根据化学平衡常数进行有关计算,注意反应方向的判断,根据浓度变化量确定反应方向,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |

(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是可随时控制反应的进行和停止.
(2)说明SO2气体产生的实验现象是品红褪色;装置C的作用是吸收多余的SO2气体,防止尾气污染(环境).
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
①提出假设:假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+.
②请设计实验方案验证假设3.
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液.
| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
①NaOH溶液②品红溶液③溴水④Ca(OH)2溶液,选择合适试剂并安排合理的顺序为②③②④.
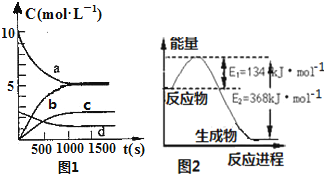 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)一定温度下,在体积为2L的恒容密闭容器中充入20molNO2和5molO2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如图1:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4molNO2和1molO2 C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;
(2)图2是1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,则反应:
N2(g)+2NO2(g)?4NO(g) 的△H=+292.3kJ•mol-1.
 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$\stackrel{60℃-80℃}{→}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置.在实验开始时温度计水银球的位置应在试管A的反应液中,目的是控制反应温度为60℃~80℃;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在在试管A的支管口处.
(3)烧杯B内盛装的液体可以是甘油(写出一种即可).
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是ab.(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液.
| A. | 1mol水的质量为18g/mol | |
| B. | 标准状况下,3.01×1023个CO2分子的质量为22g | |
| C. | 标准状况下,1mol任何物质体积约为22.4 L | |
| D. | 二氧化硫的摩尔质量是64 g |

