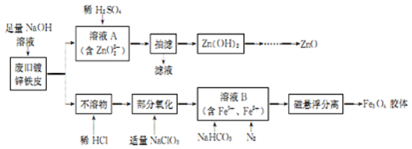
题目内容
11.亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO3)2并对其性质进行探究.【背景素材】
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO3)2+H2O
Ⅱ.Ca(NO3)2能被酸性KmnO4溶液氧化成NO3-,MnO4-被还原为Mn2+
Ⅲ.在酸性条件下,Ca(NO3)2能将I-氧化为I2,S2O32-能将I2还原为I-
【制备氮氧化物】
(1)甲组同学拟利用如图所示装置制备氮氧化物.
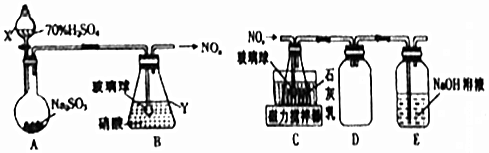
①仪器X、Y的名称分别是分液漏斗、锥形瓶.
②装置B中逸出的NO与NO2的物质的量之比为1:1,则装置B中发生反应的化学方程式为2SO2+H2O+2HNO3=NO+NO2+2H2SO4.
【制备Ca(NO2)2】
(2)乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图.
①装置C中导管末端接一玻璃球的作用是增大与石灰乳的接触面积.
②装置D的作用是防倒吸;装置E的作用是吸收未反应的氮氧化物.
【测定Ca(NO2)2的纯度】
(3)丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1mol•L-1的KI溶液 c.淀粉溶液 d.c2mol•L-1的Na2S2O3溶液e.c3mol•L-1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定起其纯度,可选择的试剂是e(填字母).
②利用Ca(NO2)2的氧化性来测定起纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,加入过量的c1mol•L-1KI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol•L-1Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读取消耗的Na2S2O3溶液体积,重复以上操作2~3次(请补充完整实验步骤)
分析 A装置由浓硫酸和亚硫酸钠制备二氧化硫气体,二氧化硫气体与硝酸在B中反应生成氮氧化合物,在C中与石灰乳发生反应NO+NO2+Ca(OH)2=Ca(NO2)2+H2O,可制备得Ca(NO2)2,D装置防倒吸,E装置用氢氧化钠吸收未反应完的氮氧化物,防止污染空气,据此分析解答.
解答 解:(1)①由仪器构造可知X为分液漏斗,Y为锥形瓶;
故答案为:分液漏斗;锥形瓶;
②装置B中逸出的NO与NO2的物质的量之比为1:1,则装置B中发生反应的化学方程式为2SO2+H2O+2HNO3=NO+NO2+2H2SO4;故答案为:2SO2+H2O+2HNO3=NO+NO2+2H2SO4;
(2)①装置C中导管末端接一玻璃球可增大与石灰乳的接触面积;
故答案为:增大与石灰乳的接触面积;
②装置D的作用是防倒吸,E装置用氢氧化钠吸收未反应完的氮氧化物,防止污染空气;
故答案为额:防倒吸;吸收未反应的氮氧化物;
(3)①由信息Ca(NO2)2能被酸性KmnO4溶液氧化成NO3-,MnO4-被还原为Mn2+可知,则利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是e;
故答案为:e;
②由信息在酸性条件下,Ca(NO3)2能将I-氧化为I2,S2O32-能将I2还原为I-可知,则利用Ca(NO2)2的氧化性来测定其纯度的步骤是:准确称取质量为m的Ca(NO2)2样品放入锥形瓶中,加适量水溶解,加入过量的c1 mol•L-1 KI溶液、淀粉溶液,然后滴加稀硫酸,用c2 mol•L-1 Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读取消耗的Na2S2O3溶液体积,重复以上操作2~3次;
故答案为:加入过量的c1 mol•L-1 KI溶液、淀粉溶液,然后滴加稀硫酸,用c2 mol•L-1 Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读取消耗的Na2S2O3溶液体积,重复以上操作2~3次.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验装置的作用、氧化还原反应的应用为解答的关键,侧重分析与实验及应用能力的综合考查,题目难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案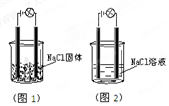 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | B. | NaCl溶液是电解质 | ||
| C. | NaCl在水溶液中离子键发生断裂 | D. | NaCl溶液中水电离出大量的离子 |
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
| A. | 由同种元素组成的物质一定是纯净物 | |
| B. | 科学家最近合成了一种新型的化合物N4 | |
| C. | 红磷转化为白磷是物理变化 | |
| D. | 纳米泡沫碳与金刚石是同素异形体 |
H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
H2S(g)+O2(g)=S(g)+H2O(g)△H3
2S(g)=S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |
| A. | HCl | B. | CO(NH2)2 | C. | CO2 | D. | H2O |