题目内容
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色.
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色.
| A、①③⑥⑧ | B、③⑦⑧ |
| C、②⑤⑥⑦ | D、①④⑧ |
考点:钠的重要化合物
专题:元素及其化合物
分析:Na2O2的电子式为 ,可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以此解答.
,可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以此解答.
 ,可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以此解答.
,可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以此解答.解答:
解:反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,
①.Na2O2的电子式为 ,故阴、阳离子的个数比为1:2,故错误;
,故阴、阳离子的个数比为1:2,故错误;
②.生成相同量的O2时消耗的水和二氧化碳的物质的量相同,但质量不同,故错误;
③.由得失电子守恒知两者转移电子的物质的量相同,故正确;
④.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,故原理不同,故错误;
⑤.因为过氧化钠具有强氧化性,二氧化硫具有强还原性,所以Na2O2+SO2=Na2SO4,故错误;
⑥.Na2O2能和盐酸反应生成氯化钠和水和氧气,为过氧化物,不是碱性氧化物,故错误;
⑦.Na2O2与水反应,Na2O2既是氧化剂,又是还原剂,故正确;
⑧.Na2O2投入到紫色石蕊试液中,与水反应生成氢氧化钠成碱性所以溶液先变蓝,又因为过氧化钠具有强氧化性而有漂白性,所以后褪色,故正确;
故选B.
①.Na2O2的电子式为
 ,故阴、阳离子的个数比为1:2,故错误;
,故阴、阳离子的个数比为1:2,故错误;②.生成相同量的O2时消耗的水和二氧化碳的物质的量相同,但质量不同,故错误;
③.由得失电子守恒知两者转移电子的物质的量相同,故正确;
④.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,故原理不同,故错误;
⑤.因为过氧化钠具有强氧化性,二氧化硫具有强还原性,所以Na2O2+SO2=Na2SO4,故错误;
⑥.Na2O2能和盐酸反应生成氯化钠和水和氧气,为过氧化物,不是碱性氧化物,故错误;
⑦.Na2O2与水反应,Na2O2既是氧化剂,又是还原剂,故正确;
⑧.Na2O2投入到紫色石蕊试液中,与水反应生成氢氧化钠成碱性所以溶液先变蓝,又因为过氧化钠具有强氧化性而有漂白性,所以后褪色,故正确;
故选B.
点评:本题考查过氧化钠的性质,为高考高频考点,侧重于学生的分析能基础知识的综合运用,注意把握反应的化学方程式,根据方程式可解答该题,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
室温时,盐酸和硫酸的混合溶液20ml,向混合溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )


| A、图中A点对应溶液的pH=l |
| B、生成沉淀的最大质量m=2.33 g |
| C、原混合溶液中盐酸物质的量浓度为0.1 mol?L-1 |
| D、当V[Ba(OH)2(aq)]=10 mL时,发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
 某有机物与H2按1:1的物质的量之比加成后生成的产物结构为:则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)( )
某有机物与H2按1:1的物质的量之比加成后生成的产物结构为:则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)( )| A、3种 | B、4种 | C、5种 | D、6种 |
某试样的焰色反应呈黄色,下列关于试样成分的说法正确的是( )
| A、肯定是钠单质 |
| B、肯定是钠的化合物 |
| C、肯定含有钠元素 |
| D、肯定含有钾元素 |
对于可逆反应A(g)+3B(g)?2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A、V(A)=0.5 mol/(L?min) |
| B、V(B)=1.2 mol/(L?min) |
| C、V(C)=0.4 mol/(L?min ) |
| D、V(C)=1.1 mol/(L?min) |
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列说法正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列说法正确的是( )A、断开K2,闭合K1时,总反应的离子方程式为2H++2Cl-
| ||||
| B、断开K2、闭合K1时,石墨电极附近溶液变红 | ||||
| C、断开K1、闭合K2时,铜电极上的电极反应为Cl2+2e-═2Cl- | ||||
| D、断开K1、闭合K2时,石墨电极作正极 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题: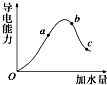 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: