题目内容
将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1L、物质的量浓度为1.84mol/L、密度为1.20g/cm3的稀硫酸.求:
(1)求浓硫酸的物质的量浓度;
(2)所需浓硫酸的体积.
(1)求浓硫酸的物质的量浓度;
(2)所需浓硫酸的体积.
考点:物质的量浓度的相关计算
专题:
分析:(1)根据c=
计算浓硫酸的物质的量浓度;
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓硫酸的体积.
| 1000ρω |
| M |
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓硫酸的体积.
解答:
解:(1)根据c=
可知,密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为
mol/L=18.4mol/L,
答:该浓硫酸的物质的量浓度为18.4mol/L;
(2)设需要浓硫酸的体积为VL,根据稀释定律,稀释前后溶质的物质的量不变,则:
1L×1.84mol/L=V L×18.4mol/L
解得V=0.1L
答:需要浓硫酸的体积为0.1L.
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
答:该浓硫酸的物质的量浓度为18.4mol/L;
(2)设需要浓硫酸的体积为VL,根据稀释定律,稀释前后溶质的物质的量不变,则:
1L×1.84mol/L=V L×18.4mol/L
解得V=0.1L
答:需要浓硫酸的体积为0.1L.
点评:本题考查物质的量浓度有关计算,难度不大,注意对公式的理解与灵活应用,理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),已知H2、I2、HI、的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、HI为0.3mol/L |
| B、I2为0.4mol/L |
| C、H2为0.2mol/L |
| D、HI为0.4mol/L |
已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关化学用语表示正确的是( )
A、N2的电子式: | ||
B、S2-的结构示意图: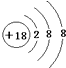 | ||
C、质子数为53、中子数为78的碘原子:
| ||
| D、16O2与18O3互为同位素 |
将标准状况下密度为ρg/L的HCl气体V L溶于1000g水中,得到密度为b g/cm3的盐酸,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|