题目内容
12.已知元素A的最高正价与最低负价的代数和为零.取5.6g元素A的单质与足量的烧碱溶液完全反应后,生成A的最高价化合物的同时收集到标况下氢气8.96L.元素A的原子核中质子数与中子数相等.(1)试确定元素A在元素周期表中的位置第三周期第ⅣA族
(2)写出两种与A的气态氢化物分子具有相同电子数的双原子分子的化学式HCl、F2.
分析 元素A的最高正价与最低负价的代数和为零,则A位于ⅣA族,其最高正价为+4价;标准状况下8.96L氢气的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,根据电子守恒可知5.6gA的物质的量为:$\frac{0.4mol×2}{4}$=0.2mol,则A的摩尔质量为:$\frac{5.6g}{0.2mol}$=28g/mol,A的相对原子质量为28,由于元素A的原子核中质子数与中子数相等,则A原子的质子数=中子数=$\frac{28}{2}$=14,则A为Si元素,据此进行解答.
解答 解:元素A的最高正价与最低负价的代数和为零,则A位于ⅣA族,其最高正价为+4价;标准状况下8.96L氢气的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,根据电子守恒可知5.6gA的物质的量为:$\frac{0.4mol×2}{4}$=0.2mol,则A的摩尔质量为:$\frac{5.6g}{0.2mol}$=28g/mol,A的相对原子质量为28,由于元素A的原子核中质子数与中子数相等,则A原子的质子数=中子数=$\frac{28}{2}$=14,则A为Si元素,
(1)根据分析可知,A为Si元素,原子序数为14,位于周期表中第三周期第ⅣA族,
故答案为:第三周期第ⅣA族;
(2)A为Si,其气态氢化物为SiH4,SiH4分子中含有18个电子,含有18个电子的双原子分子有:HCl、F2,
故答案为:HCl;F2.
点评 本题考查了位置、结构与性质关系的应用,题目难度不大,推断A元素的名称为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.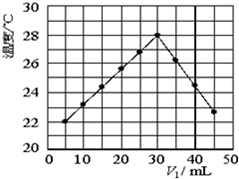 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )| A. | 做该实验时环境温度可能为20℃ | B. | 该实验表明化学能可以转化为热能 | ||
| C. | NaOH溶液的浓度约是1.5mol•L-1 | D. | 该实验表明中和反应是放热反应 |
17.用水能鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙酸乙酯和乙醇 | C. | 苯和乙酸乙酯 | D. | 四氯化碳和溴苯 |
4.下列指定微粒的数目相等的是( )
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数 |
1.下列化学方程式书写正确的是( )
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HO3(浓)=3Cu(NO3)2+2NO↑+4H2O | ||
| C. |  | D. | 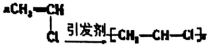 |