题目内容
9.将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:(1)NO的体积为5.6L.
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为$\frac{50+0.1aV}{14}$mol/L.
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水57.8g.(保留1位小数)
分析 (1)n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,氮氧化物的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据得失电子守恒计算二者的物质的量;
(2)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸钠的化学式计算起酸作用的硝酸,再根据物质的量浓度公式计算硝酸的物质的量浓度;
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水.
解答 解:(1)n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,氮氧化物的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,
设NO的物质的量是xmol,NO2的物质的量是ymol,
$\left\{\begin{array}{l}{x+y=0.5}\\{1.5x+0.5y=0.5}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.25}\\{y=0.25}\end{array}\right.$,则NO的体积为0.25×22.4=5.6L,
故答案为:5.6L;
(2)将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得起酸作用的硝酸的物质的量=0.001aVmol,根据N原子守恒作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度=$\frac{0.5mol+0.001aVmol}{0.14L}$=$\frac{50+0.1aV}{14}$mol/L,
故答案为:$\frac{50+0.1aV}{14}$;
(3)设需要30%的双氧水mg,根据电子得失守恒,有:0.25×3+0.25×1=0.5×2=30%×$\frac{m}{34}$×2,解得:m=57.8,故答案为:57.8.
点评 本题以硝酸为载体考查了氧化还原反应的计算,根据氧化还原反应中得失电子进行解答即可,注意守恒思想的运用,注意(2)中不能根据铜计算消耗硝酸的物质的量,铜和硝酸反应时,硝酸可能有剩余,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 1:1:1 | B. | 1:4:2 | C. | 1:2:4 | D. | 1:3:2 |
| A. | 12 | B. | 14 | C. | 28 | D. | 32 |
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 碳酸钙溶于稀盐酸中 CO32─+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3─+H+═CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
| A. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| A. | 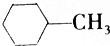 的一氯代物最多有4种 的一氯代物最多有4种 | |
| B. | 乙酸可与乙醇、金属钠、新制Cu(OH)2悬浊液等物质反应 | |
| C. | Cl2可与乙烷发生取代反应,与乙烯发生加成反应 | |
| D. | 阿托酸(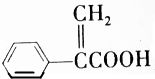 )可用于合成高分子材料 )可用于合成高分子材料 |