题目内容
7.X、Y、Z是主族元素的单质,K、H是化合物,它们有如下反应(式中化学计量系数和反应条件略)①X+K→H+Y
②X+Z→H
③Y+Z→K
(1)若X和Y的组成元素不是同一主族,请写出符合①式的三个不同的化学方程式2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,2Al+6HCl=2AlCl3+3H2↑,Cl2+H2S=S+2HCl(三个式子中的三种X和三种Y,分别由不同族的元素组成),
(2)今有淡黄色化合物W,它跟化合物K或CO2反应,都能生成单质Y.符合化学方程式①、②、③的单质X是F2,单质Y是O2,单质Z是H2化合物W是Na2O2.
分析 (1)若X和Y的组成元素不是同一主族,X、Y、Z是主族元素的单质,K、H是化合物,①X+K→H+Y为置换反应,镁在二氧化碳中燃烧生成碳和氧化镁,铝和盐酸反应生成氢气,氯气和硫化氢反应生成单质硫;
(2)今有淡黄色化合物W,它跟化合物K或CO2反应,都能生成单质Y,则W为Na2O2,K位H2O,Y为O2,则X为F2,H为HF,Z为H2.
解答 解:(1)若X和Y的组成元素不是同一主族,X、Y、Z是主族元素的单质,K、H是化合物,①X+K→H+Y为置换反应,镁在二氧化碳中燃烧生成碳和氧化镁,铝和盐酸反应生成氢气,氯气和硫化氢反应生成单质硫,符合①式的三个不同的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,2Al+6HCl=2AlCl3+3H2↑,Cl2+H2S=S+2HCl,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,2Al+6HCl=2AlCl3+3H2↑,Cl2+H2S=S+2HCl;
(2)X、Y、Z是主族元素的单质,K、H是化合物,今有淡黄色化合物W,它跟化合物K或CO2反应,都能生成单质Y,则W为Na2O2,K位H2O,Y为O2,则X为F2,H为HF,Z为H2,
故答案为:F2;O2;H2;Na2O2;
点评 本题考查了无机物质的分析应用,主要是置换反应、物质性质的判断,注意知识的积累和熟练掌握,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列反应的离子方程式中,正确的是( )
| A. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
18.取一定量含FeO、Fe3O4和Fe2O3的固体混合物,将其分成两等份并进行下列转化:
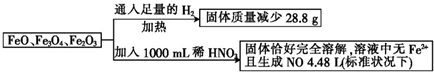
若稀HNO3恰好完全反应,则所加稀HNO3的物质的量浓度为( )

若稀HNO3恰好完全反应,则所加稀HNO3的物质的量浓度为( )
| A. | 4.0 mol•L-1 | B. | 4.4 mol•L-1 | C. | 4.8 mol•L-1 | D. | 3.6 mol•L-1 |
 .
. X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: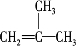 .
. .
. ,元素D在元素周期表中的位置是第三周期VIIA族.
,元素D在元素周期表中的位置是第三周期VIIA族.