题目内容
15.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )| A. | 氯化硼分子间含有氢键 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈正三角形,属非极性分子 | |
| D. | 其分子空间结构类似CH4O |
分析 氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,可知为分子晶体,且为平面正三角形,BCl3中B为不存在孤对电子,成键数为3,则B为sp2杂化,以此来解答.
解答 解:A.B的非金属性较弱,氯化硼分子间不含有氢键,故A错误;
B.BCl3中B为不存在孤对电子,成键数为3,则B为sp2杂化,故B错误;
C.分子中键与键之间的夹角为120°,可知氯化硼分子呈正三角形,结构对称,正负电荷的中心重合,属非极性分子,故C正确;
D.CH4O中C为四面体构型,氯化硼分子呈正三角形,空间结构不类似,故D错误;
故选C.
点评 本题考查杂化及分子构型,为高频考点,把握分子的性质及结构判断分子构型、原子杂化为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
5.下列各组物质中,所含化学键类型相同,融化时克服的作用力也相同的是( )
| A. | 明矾和金刚石 | B. | 硫磺和人黄铜 | C. | 甲烷和干冰 | D. | 氯化铵和可燃冰 |
6.下列溶液中能大量共存的离子组是( )
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
3.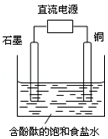 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |
10.下列单质中,最容易跟氢气发生反应,生成的氢化物最稳定的是( )
| A. | O2 | B. | N2 | C. | F2 | D. | Cl2 |
20.当1mol某气态烃与2molCl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,所得产物再与2molCl2进行取代反应后,生成只含C、Cl两种元素的化合物.则该气态烃是( )
| A. | 乙炔 | B. | 乙烯 | C. | 丁二烯 | D. | 丙炔 |
7.某温度下,向2.0L恒容密闭容器中充入2mol X和1mol Y,发生反应:2X(g)+Y(g)?2Z(g)△H,经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Z)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 若使用催化剂,则反应速率和X的转化率均增大 | |
| B. | 其他条件不变,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,则△H>0 | |
| C. | 其他条件不变,容器体积压缩到1.0 L,平衡常数将增大 | |
| D. | 温度不变,向容器中再充入2 mol X、1 mol Y,反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大 |
6.关于胶体的性质与应用,相关说法错误的是( )
| A. | 静电除尘器除去空气中的飘尘是利用胶体粒子的带电性而加以除去 | |
| B. | 溶液和胶体均为呈电中性的分散系 | |
| C. | FeCl3溶液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象 | |
| D. | 由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体比较稳定 |