题目内容
2.短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素.下列说法正确的是( )| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | W的最高价氧化物的水化物是一种弱碱 | |
| C. | Y的单质的氧化性比Z的强 | |
| D. | X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素,则Z是O、W是Na元素,其中只有Y、Z处于同一周期且相邻,且Y原子序数小于Z,则Y是N元素,X是H元素;
A.原子的电子层数越多其原子半径越大,原子的电子层数相同的元素,其原子半径随着原子序数增大而减小;
B.W的最高价氧化物的水化物是NaOH;
C.Y单质是氮气、Z单质是氧气,元素的非金属性氧气,其单质的氧化性越强;
D.X、Y、Z三种元素组成的化合物可能是硝酸、硝酸铵.
解答 解:短周期主族元素X、Y、Z、W原子序数依次增大,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素,则Z是O、W是Na元素,其中只有Y、Z处于同一周期且相邻,且Y原子序数小于Z,则Y是N元素,X是H元素;
A.原子的电子层数越多其原子半径越大,原子的电子层数相同的元素,其原子半径随着原子序数增大而减小,X位于第一周期、Y和Z位于第二周期且原子序数Y<Z,W位于第三周期,所以原子半径:r(X)<r(Z)<r(Y)<r(W),故A错误;
B.W的最高价氧化物的水化物是NaOH,NaOH是强碱,故B错误;
C.Y单质是氮气、Z单质是氧气,元素的非金属性氧气,其单质的氧化性越强,非金属性O>N元素,所以Z单质的氧化性大于Y,故C错误;
D.X、Y、Z三种元素组成的化合物可能是硝酸、硝酸铵,硝酸是共价化合物、硝酸铵是离子化合物,故D正确;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期表结构及元素周期律是解本题关键,正确判断元素是解本题关键,注意:铵盐中不含金属元素但属于离子化合物,题目难度不大.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 植物油氢化过程中发生了加成反应 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 环己烷与苯可用酸性KMnO4溶液鉴别 | |
| D. | 水可以用来分离溴苯和苯的混合物 |
17.用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液.
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
f.数据处理.
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b.配制并标定100mL 0.1000mol•L-1 NH4SCN标准溶液,备用.
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中.
b.加入25.00mL 0.1000mol•L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c.加入NH4Fe(SO4)2溶液作指示剂.
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e.重复上述操作两次.三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有250mL(棕色)容量瓶、胶头滴管.
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是避免AgNO3见光分解.
(3)滴定应在pH<0.5的条件下进行,其原因是防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解).
(4)b和c两步操作是否可以颠倒否(或不能),说明理由若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点.
(5)所消耗的NH4SCN标准溶液平均体积为10.00mL,测得c(I-)=0.0600mol•L-1.
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为用NH4SCN标准溶液进行润洗;.
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果偏高.
7.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 | 苯酚浓度小 |
| B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
| D | 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 | 溶液中含 Br2 |
| A. | A | B. | B | C. | C | D. | D |
5.一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g)?CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
| A. | v生成(CH3OH)=v消耗(CO) | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | CO、H2、CH3OH的浓度比为1:2:1 |
2.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 | |
| B. | 苯是从煤和石油中加工制得的一种重要的化工原料 | |
| C. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油 |
8.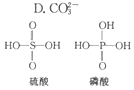 无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )
无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )
 无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )
无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )| A. | 硫酸和磷酸都是强酸 | B. | 硫酸的酸性比磷酸弱 | ||
| C. | 磷酸和硫酸都是弱酸 | D. | 硫酸的酸性比磷酸强 |
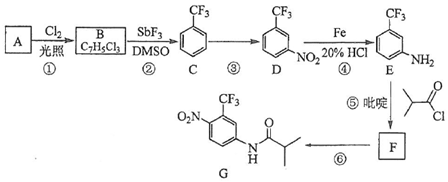
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.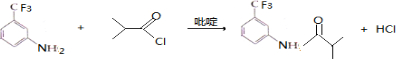 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.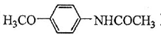 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(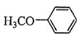 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选).