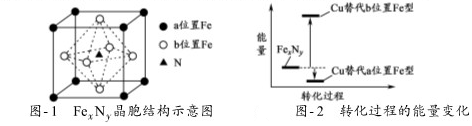
题目内容
5.一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g)?CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )| A. | v生成(CH3OH)=v消耗(CO) | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | CO、H2、CH3OH的浓度比为1:2:1 |
分析 可逆反应CO(g)+2H2(g)?CH3OH(g)为气体体积缩小的反应,当正逆反应速率相等时,各组分的浓度、百分含量等不再变化,说明达到平衡状态,据此进行解答.
解答 解:A.v生成(CH3OH)=v消耗(CO),表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故A错误;
B.该反应前后都是气体,气体的总质量始终不变,容器的容积不变,则密度不是变量,无法根据密度判断平衡状态,故B错误;
C.该反应为气体体积缩小的反应,气体的物质的量发生变化,而气体总质量不变,则平均相对分子质量为变量,当平均相对分子质量不再变化时,说明达到平衡状态,故C正确;
D.CO、H2、CH3OH的浓度比为1:2:1,无法判断各组分的浓度是否变化,则无法判断平衡状态,故D错误;
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握化学平衡及其影响,B为易错点,注意密度不是变量,试题培养了学生的灵活应用能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
10.在一定温度下的恒容密闭容器中,加入等物质的量的A与B物质,A(s)+2B(g)?C(g)+D(g)达到平衡后B的转化率为a,再向容器内加入一定量的B物质达新平衡,下列说法正确的是( )
| A. | 若改为加入A物质可加快反应速率 | |
| B. | 达新平衡后B的转化率减小,A的转化率增大 | |
| C. | 达新平衡后A与B的转化率均增大 | |
| D. | 达新平衡后B的转化率不变,A的转化率增大 |
2.短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | W的最高价氧化物的水化物是一种弱碱 | |
| C. | Y的单质的氧化性比Z的强 | |
| D. | X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
10.下列行为中符合安全要求的是( )
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在煤气炉灶处检验是否漏气 | |
| C. | 用水浇灭钠等金属的着火 | |
| D. | 在大型庆祝活动场地,可以放充氦气的气球 |
17.下列有关实验仪器的使用及实验操作正确的是( )
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85g NaCl |
20.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1,W在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | X的单质可由金属单质置换得到 |

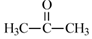 )分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
)分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.