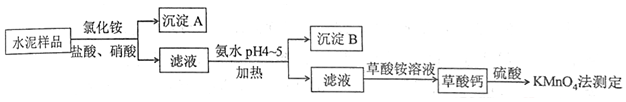
题目内容
10.凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知:NH3+H3BO3=NH3•H3BO3;NH3•H3BO3+HCl=NH4Cl+H3BO3.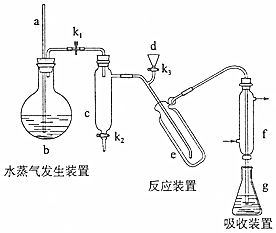
回答下列问题:
(1)a的作用是平衡气压,以免关闭K1后圆底烧瓶内气压过大.
(2)b中放入少量碎瓷片的目的是防止暴沸.f的名称是冷凝管.
(3)清洗仪器:g中加蒸馏水:打开K1,关闭K2、K3,加热b,蒸气充满管路:停止加热,关闭K1,g中蒸馏水倒吸进入c,原因是c、e及其所连接的管道内水蒸气冷凝为水后,气压远小于外界大气压,在大气压的作用下,锥形瓶内的蒸馏水被倒吸入c中;打开K2放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭K3,d中保留少量水,打开K1,加热b,使水蒸气进入e.
①d中保留少量水的目的是便于检验d装置是否漏气,同时起到液封,防止氨气逸出的作用.
②e中主要反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,e采用中空双层玻璃瓶的作用是减少热量损失,有利于铵根离子转化为氨气而逸出.
(5)取某甘氨酸(C2H5NO2)样品m克进行测定,滴定g中吸收液时消耗浓度为cmol•L-1的盐酸V mL,则样品中氮的质量分数为$\frac{1.4cV}{m}$%,样品的纯度≤$\frac{7.5cV}{m}$%.
分析 (1)a为玻璃管,可连接空气,避免烧瓶内压强过大;
(2)加热纯液体时,应避免液体暴沸;
(3)冷却后,装置内压强较低,可倒吸;
(4)①d中保留少量水,可检验装置是否漏气并防止气体逸出;
②铵盐试样由d注入e,随后注入氢氧化钠溶液,发生反应生成氨气;e采用中空双层玻璃瓶,起到保温作用;
(5)滴定g中吸收液时消耗浓度为cmol•L-1的盐酸V mL,则n(HCl)=0.001cVmol;结合反应NH3•H3BO3+HCl=NH4Cl+H3BO3可知,n(N)=n(NH4Cl)=n(C2H3NO2)=n(HCl),以此解答该题.
解答 解:(1)a为玻璃管,可连接空气,避免在加热时烧瓶内压强过大,故答案为:平衡气压,以免关闭K1后圆底烧瓶内气压过大;
(2)加热纯液体时,加入碎瓷片可避免液体暴沸,F为冷凝管,故答案为:防止暴沸;冷凝管;
(3)停止加热,关闭K1,g中蒸馏水倒吸进入c,原因是c、e及其所连接的管道内水蒸气冷凝为水后,气压远小于外界大气压,在大气压的作用下,锥形瓶内的蒸馏水被倒吸入c中,
故答案为:c、e及其所连接的管道内水蒸气冷凝为水后,气压远小于外界大气压,在大气压的作用下,锥形瓶内的蒸馏水被倒吸入c中;
(4)①d中保留少量水,可检验装置是否漏气,如漏气,液面会下降,且起到防止漏气的作用,
故答案为:便于检验d装置是否漏气,同时起到液封,防止氨气逸出的作用;
②铵盐试样由d注入e,随后注入氢氧化钠溶液,发生反应生成氨气,反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;e采用中空双层玻璃瓶,起到保温作用,以减少热量损失,有利于铵根离子转化为氨气而逸出,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;减少热量损失,有利于铵根离子转化为氨气而逸出;
(5)滴定g中吸收液时消耗浓度为cmol•L-1的盐酸V mL,则n(HCl)=0.001cVmol;结合反应NH3•H3BO3+HCl=NH4Cl+H3BO3可知,n(N)=n(NH4Cl)=n(C2H5NO2)=n(HCl),
则m(N)=0.001cVmol×14g/mol=0.014cVg,则样品中氮的质量分数为$\frac{0.014cV}{m}×100%$=$\frac{1.4cV}{m}$%,
m(C2H5NO2)=0.001cVmol×75g/mol=0.075cVg,则样品的纯度为$\frac{0.075cV}{m}×100%$=$\frac{7.5cV}{m}$%,
故答案为:$\frac{1.4cV}{m}$;$\frac{7.5cV}{m}$.
点评 本题考查含量的测定实验设计,为高考常见题型,试题涉及了元素化合物的性质、实验原理、物质制备等,侧重考查学生对实验方案理解及对元素化合物的知识的应用能力,难度中等.

 高效智能课时作业系列答案
高效智能课时作业系列答案
| A. | 利用图甲装置,可快速制取氨气 | |
| B. | 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. | 利用图丙装置,可制取乙烯并验证其易酸性KMnO4溶液氧化 | |
| D. | 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
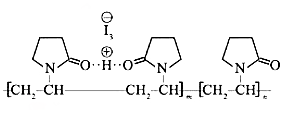 (图中虚线表示氢键)
(图中虚线表示氢键)下列说法不正确的是( )
| A. | 聚维酮的单体是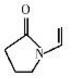 | |
| B. | 聚维酮分子由(m+n)个单体聚合而成 | |
| C. | 聚维酮碘是一种水溶性物质 | |
| D. | 聚维酮在一定条件下能发生水解反应 |
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“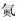 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | W的最高价氧化物的水化物是一种弱碱 | |
| C. | Y的单质的氧化性比Z的强 | |
| D. | X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在煤气炉灶处检验是否漏气 | |
| C. | 用水浇灭钠等金属的着火 | |
| D. | 在大型庆祝活动场地,可以放充氦气的气球 |
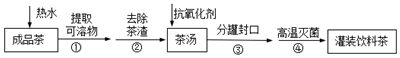
| A. | 步骤②是过滤 | |
| B. | 步骤③是分液,主要仪器是分液漏斗 | |
| C. | 步骤④高温灭菌的原理是使蛋白质细菌变性 | |
| D. | 茶多酚容易被氧化,抗氧化剂可选用维生素C |