题目内容
6.1LNaOH溶液中含有20gNaOH,该溶液物质的量浓度为( )| A. | 0.5mol/L | B. | 0.05mol/L | C. | 0.4mol/L | D. | 0.01mol/L |
分析 根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算相关物理量.
解答 解:n(NaOH)=$\frac{20g}{40g/mol}$=0.5mol,
c(NaOH)=$\frac{0.5mol}{1L}$=0.5mol/L,
故选A.
点评 本题考查物质的量的相关计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,注意相关计算公式的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
14.已知有关物质的熔、沸点数据如表:
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
11.下列分散系能产生“丁达尔效应”的是( )
| A. | 稀硫酸 | B. | 硫酸铜溶液 | C. | 氢氧化铁胶体 | D. | 酒精溶液 |
18.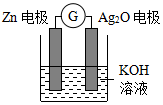 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )| A. | Zn电极是负极 | |
| B. | Ag2O电极上发生还原反应 | |
| C. | Zn电极的电极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 放电前后电解质溶液的pH保持不变 |
8.NaHS不属于( )
| A. | 酸式盐 | B. | 含氧酸盐 | C. | 钠盐 | D. | 无氧酸盐 |
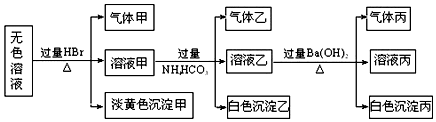
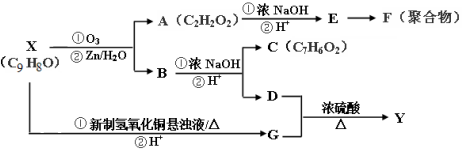
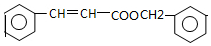 .
.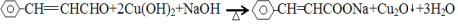 .
.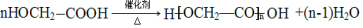 .
. .
.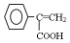 ,写出以
,写出以 为有机原料,制取H的合成路线(可任选无机原料).
为有机原料,制取H的合成路线(可任选无机原料).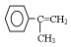 →
→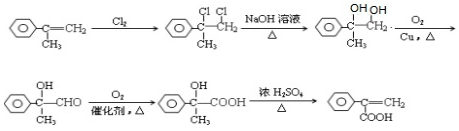 .
.