题目内容
5.已知H-H 键的键能为436kJ•mol-1,Cl-Cl键的键能为243kJ•mol-1,H-Cl键的键能为431kJ•mol-1,则H2 (g )+Cl2(g )═2HCl(g ) 的反应热(△H )等于( )| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
分析 焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:H-H 键的键能为436kJ•mol-1,Cl-Cl键的键能为243kJ•mol-1,H-Cl键的键能为431kJ•mol-1,
由焓变等于反应物中键能之和减去生成物中键能之和可知,
H2 (g )+Cl2(g )═2HCl(g ) 的△H=436kJ•mol-1+243kJ•mol-1-2×(431kJ•mol-1)=-183 kJ•mol-1,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与计算能力的考查,注意判断物质中的化学键数目,题目难度不大.

练习册系列答案
相关题目
13.下列关于反应热的说法正确的是( )
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol |
20.化学反应中通常伴随着能量变化,下列说法中错误的是( )
| A. | 煤燃烧时并不能将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池放电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
14.某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:

(1)检验如图装置气密性的最简便方法为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好.
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
(3)该实验探究的是浓度因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是②>①(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0052mol/L(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①该反应为放热反应、②产物Mn2+是反应的催化剂、③K+对该反应有催化作用.
| 实验序号 | A 溶液 | B 溶液 |
| ① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1KMnO4 酸性溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好.
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
(3)该实验探究的是浓度因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是②>①(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0052mol/L(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①该反应为放热反应、②产物Mn2+是反应的催化剂、③K+对该反应有催化作用.
15.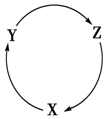 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )
 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )| X | Y | Z | |
| A | CO | CO2 | H2CO3 |
| B | Cu | CuO | Cu(OH)2 |
| C | CaO | Ca(OH)2 | CaCO3 |
| D | H2SO4 | Na2SO4 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
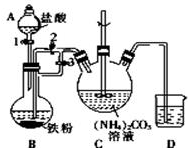 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.


