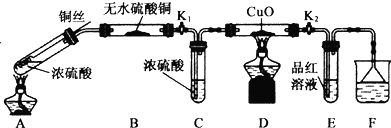
题目内容
15. 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
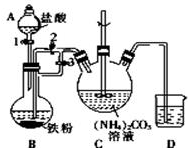
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.I.制备碳酸亚铁:装置如图所示.
(1)B中可观察到的现象是铁粉逐渐溶解,有气泡冒出,溶液变成浅绿色.
将B中生成的FeCl2溶液压入装置C的操作是关闭活塞3,打开活塞2.Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
(2)加入少量铁粉的作用是防止Fe2+被氧化,反应后加入适量乳酸的作用是除去剩余铁粉.
(3)从所得溶液中获得乳酸亚铁晶体所需的实验操作是冷却结晶、过滤、洗涤、干燥.
(4)设计实验证明乳酸亚铁中含Fe2+取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色.
分析 (1)装置B中铁粉与稀盐酸反应生成氢气和氯化亚铁,据此判断反应现象;关闭活塞3、打开活塞2,产生的氢气使圆底烧瓶中压强增大,从而可将氯化亚铁溶液压人装置C;
(2)制备乳酸亚铁过程中加入Fe粉,可防止Fe2+离子被氧化,加入乳酸的目的是除去剩余铁粉;
(3)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;
(4)先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子.
解答 解:(1)装置B中铁粉与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,则观察到的现象为:铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色;先关闭活塞3、打开活塞2,铁与稀盐酸反应生成的氢气使圆底烧瓶中压强增大,从而将B中生成的FeCl2溶液压入装置C,
故答案为:有气泡冒出、溶液变成浅绿色;关闭活塞3,打开活塞2;
(2)制备乳酸亚铁过程中加入Fe粉,可防止Fe2+离子被氧化,过量的铁粉需要用乳酸除去,
故答案为:防止Fe2+被氧化;除去剩余铁粉;
(3)在75℃下搅拌使之充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作,
故答案为:冷却结晶;过滤;
(4)证明乳酸亚铁中含Fe2+的方法为:取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色,
故答案为:取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色.
点评 本题考查了制备方案的设计与评价,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握物质制备方案的设计与评价原则,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
| A. | 该条件下Z是气态 | B. | 平衡常数K=$\frac{c(Z)•c(W)}{c(X)•c(Y)}$ | ||
| C. | 增加Z平衡逆向移动 | D. | 上述过程中X的转化率变大 |
Ⅰ.称取一定量的铁屑于锥形瓶中,加入过量的6mol•L-1的盐酸,在通风橱中充分反应;
Ⅱ.根据FeCl2的理论产量,加入足量的氧化剂X;
Ⅲ.FeCl3溶液通过一系列操作制得无水FeCl3.
已知:不同温度下六水合FeCl3在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
(1)请选择本实验中合适的氧化剂XCD.
A.KMnO4(H+) B.稀硝酸 C.H2O2 D.Cl2
(2)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:
①加入盐酸后,②蒸发浓缩、冷却结晶,③过滤、洗涤,④干燥.
(3)过滤后用少量乙醇洗涤FeCl3•6H2O晶体,选用乙醇的原因是洗去晶体表面的水,减少氯化铁晶体的溶解损耗.
(4)FeCl3的质量分数通常可用碘量法测定:
称取m g无水FeCl3样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①配制FeCl3溶液所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需100mL容量瓶;
②在FeCl3质量分数测定的实验过程中,下列说法正确的是CD.
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中FeCl3的质量分数的测量结果偏高
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③滴定终点的现象是:溶液由蓝色变无色,且半分钟内不变色,样品中FeCl3的质量分数$\frac{162.5cV}{m}%$.
已知:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
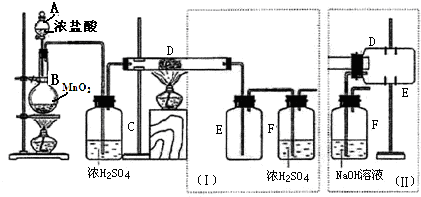
①D中的反应开始前,需排除装置中的空气,应采取的方法是:B中反应进行一段时间后,看到黄绿色气体充满装置B中,再加热装置D的反应管.
②产品收集采用装置(Ⅱ)的主要优点是:导管易被产品堵塞,尾气排入空气,易造成环境污染.
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素.
①写出Fe(NO3)3水解的离子方程式Fe3++3H2O?Fe(OH)3+3H+.
②参照示例完成下表实验方案的设计.
限选材料:0.5mol•L-1Fe(NO3)3、3.0mol•L-1HNO3、1.0mol•L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;广泛pH试纸、pH计及其他常见仪器.
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| ①溶液的酸性 | 取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴3.0mol•L-1HNO3. | 现象:棕黄色溶液颜色变浅; 结论:酸性增强抑制Fe3+水解. |
| ②溶液的浓度 | 取10mL0.5mol•L-1 Fe(NO3)3于烧杯中,用pH计测得pH1.另取90mL蒸馏水加入烧杯,充分搅拌,再测得pH2. | 现象:pH2-pH1<1(或正确表达) 结论:稀释促进水解(或平衡右移) |
| ③溶液的温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,用酒精灯加热一段时间,观察溶液颜色 | 现象:加热后溶液颜色变深 结论:升高温度促进Fe3+水解 |
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |