题目内容
20.化学反应中通常伴随着能量变化,下列说法中错误的是( )| A. | 煤燃烧时并不能将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池放电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
分析 A.还转化为光能;
B.原电池是化学能转化为电能的装置;
C.充电电池是电能转化为化学能;
D.镁条燃烧时化学能转化为热能.
解答 解:A.煤燃烧是化学能转化为热能和光能,故A正确;
B.原电池将化学能转化为电能,故B正确;
C.充电电池充电过程是电解原理,是电能转化为化学能,放电时将化学能转化为电能,故C错误;
D.镁条燃烧时放光、放热,即化学能转化为光能和热能,故D正确.
故选C.
点评 本题考查了化学反应能量变化,为高频考点,侧重于学生的双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
11.下列说法中不正确的是( )
| A. | 在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应 | |
| B. | 1 mol A(强酸)与1 mol B(强碱)发生中和反应所放出的热量叫做中和热 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 需要加热才能发生的反应可能是吸热反应也可能是放热反应 |
8.在容积相同的两个密闭容器M和N中,保持温度为150℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b).当反应2HI(g)?H2 (g)+I2 (g) 达到平衡后,下列说法正确的是( )
| A. | 从反应开始到达到平衡,所需时间tM>tN | |
| B. | 平衡时cM(I2)=c N(I2) | |
| C. | 平衡时I2 蒸气在混合气体中的体积分数:M>N | |
| D. | HI的平衡分解率αM=αN |
15.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
5.已知H-H 键的键能为436kJ•mol-1,Cl-Cl键的键能为243kJ•mol-1,H-Cl键的键能为431kJ•mol-1,则H2 (g )+Cl2(g )═2HCl(g ) 的反应热(△H )等于( )
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
9.3.15g A物质和10.5g B物质完全反应,生成7.2g C物质、1.8g D物质和0.3mol E物质,则E的摩尔质量为( )
| A. | 15.5 g•mol-1 | B. | 85 g•mol-1 | C. | 55 | D. | 55 g•mol-1 |
10.依据下面的甲、乙、丙三图,判断下列叙述不正确的是( )
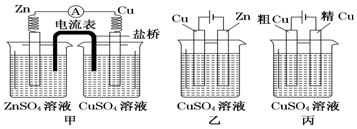

| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙装置中,铜极因发生氧化反应而溶解 | |
| D. | 乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 |