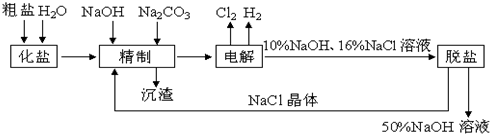
题目内容
13.下列关于反应热的说法正确的是( )| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol |
分析 A.△H为“-”时,为放热反应;
B.焓变与始态和终态有关,与反应的途径无关;
C.反应能量变化与反应物、生成物的总能量相对大小有关;
D.CO不是稳定氧化物.
解答 解:A.△H为“-”时,为放热反应,△H为“+”时,表示该反应为吸热反应,故A错误;
B.焓变与始态和终态有关,与反应的途径无关,反应体系的始态和终态决定反应的能量变化,故B正确;
C.反应热的大小与反应物所具有的能量和生成物所具有的能量有关,故C错误;
D.CO不是稳定氧化物,生成二氧化碳时的能量变化可确定燃烧热,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握焓变与反应物、生成物的能量关系为解答的关键,侧重分析与应用能力的考查,注意燃烧热的判断,题目难度不大.

练习册系列答案
相关题目
3.对于反应2A(g)+B(g)?2C(g)△H<0,下列图象正确的是( )


| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
4.(1)实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易水解,100℃左右时升华,如图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.
已知:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
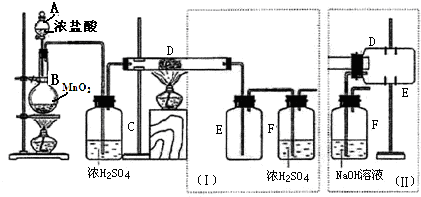
①D中的反应开始前,需排除装置中的空气,应采取的方法是:B中反应进行一段时间后,看到黄绿色气体充满装置B中,再加热装置D的反应管.
②产品收集采用装置(Ⅱ)的主要优点是:导管易被产品堵塞,尾气排入空气,易造成环境污染.
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素.
①写出Fe(NO3)3水解的离子方程式Fe3++3H2O?Fe(OH)3+3H+.
②参照示例完成下表实验方案的设计.
限选材料:0.5mol•L-1Fe(NO3)3、3.0mol•L-1HNO3、1.0mol•L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;广泛pH试纸、pH计及其他常见仪器.
已知:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑

①D中的反应开始前,需排除装置中的空气,应采取的方法是:B中反应进行一段时间后,看到黄绿色气体充满装置B中,再加热装置D的反应管.
②产品收集采用装置(Ⅱ)的主要优点是:导管易被产品堵塞,尾气排入空气,易造成环境污染.
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素.
①写出Fe(NO3)3水解的离子方程式Fe3++3H2O?Fe(OH)3+3H+.
②参照示例完成下表实验方案的设计.
限选材料:0.5mol•L-1Fe(NO3)3、3.0mol•L-1HNO3、1.0mol•L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;广泛pH试纸、pH计及其他常见仪器.
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| ①溶液的酸性 | 取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴3.0mol•L-1HNO3. | 现象:棕黄色溶液颜色变浅; 结论:酸性增强抑制Fe3+水解. |
| ②溶液的浓度 | 取10mL0.5mol•L-1 Fe(NO3)3于烧杯中,用pH计测得pH1.另取90mL蒸馏水加入烧杯,充分搅拌,再测得pH2. | 现象:pH2-pH1<1(或正确表达) 结论:稀释促进水解(或平衡右移) |
| ③溶液的温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,用酒精灯加热一段时间,观察溶液颜色 | 现象:加热后溶液颜色变深 结论:升高温度促进Fe3+水解 |
1.下列描述中正确的是( )
| A. | 已知:P4(白磷,s)═4P(红磷,s)△H<0,则白磷比红磷稳定 | |
| B. | 由CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2658 kJ•mol-1可知正丁烷的标准燃烧热为2658 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1 N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 则2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746 kJ•mol-1 |
8.在容积相同的两个密闭容器M和N中,保持温度为150℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b).当反应2HI(g)?H2 (g)+I2 (g) 达到平衡后,下列说法正确的是( )
| A. | 从反应开始到达到平衡,所需时间tM>tN | |
| B. | 平衡时cM(I2)=c N(I2) | |
| C. | 平衡时I2 蒸气在混合气体中的体积分数:M>N | |
| D. | HI的平衡分解率αM=αN |
5.已知H-H 键的键能为436kJ•mol-1,Cl-Cl键的键能为243kJ•mol-1,H-Cl键的键能为431kJ•mol-1,则H2 (g )+Cl2(g )═2HCl(g ) 的反应热(△H )等于( )
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
2.下列关于反应热的叙述,正确的是( )
| A. | 分解反应均为吸热反应 | |
| B. | lmol 酸与lmol 碱恰好中和时所放出的热量叫中和热 | |
| C. | 若S ( s )+O2 (g)=SO2(g)△H1,S(g)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| D. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
3.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA | |
| D. | 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g |