题目内容
16.下列说法正确的是( )| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
分析 A、CS2为非极性分子;
B、原子总数相同、电子总数或价电子总数相同的互为等电子体;
C、六方最密堆积和面心立方最密堆积空间利用率均为74%;
D、NaCl中阴阳离子配位数是6、CsCl中阴阳离子配位数是8.
解答 解:A、CS2含有极性键,空间结构为直线型,属于非极性分子,故A错误;
B、SO2与CO2的原子数相同,电子数和价电子数都不同,所以不是等电子体,故B错误;
C、简单立方堆积空间利用率为52%,体心立方堆积空间利用率68%,六方最密堆积和面心立方最密堆积空间利用率均为74%,所以金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高,故C正确;
D、NaCl、CsCl晶体的空间结构不相似,NaCl中阴阳离子配位数是6、CsCl中阴阳离子配位数是8,故D错误;
故选C.
点评 本题考查分子空间构型判断、等电子体,晶体结构等知识点,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
11.用惰性电极电解CuSO4溶液一段时间后停止通电,若需向溶液中加入1molCu(OH)2才能使溶液恢复至电解前的状态,则电解过程中转移电子的物质的量为( )
| A. | 2mol | B. | 4mol | C. | 6mol | D. | 8mol |
1.下列是元素周期表的前三周期中的部分元素
(1)表中所标出的元素当中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ne;
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2(大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2,由共价键(离子键/共价键)组成;
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2(大于/小于);另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于Br2 (大于/小于)
| 族 周 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2(大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2,由共价键(离子键/共价键)组成;
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2(大于/小于);另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于Br2 (大于/小于)
8.下列有关化学用语表示正确的是( )
| A. | 氯乙烯的结构式:H2C=CHCl | B. | S2-的结构示意图: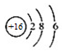 | ||
| C. | 熟石膏的化学式:2CaSO4•H2O | D. | 二氧化碳的比例模型: |
5.根据化学反应的实质是旧键断裂,新键形成这一观点,下列变化不属于化学反应的是( )
| A. | 干冰气化 | B. | O2转变成O3 | C. | 加热NH4HCO3 | D. | 加热NaHCO3 |
6.W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )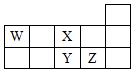

| A. | Z、Y、X的原子半径依次减小,非金属性依次降低 | |
| B. | Z、Y、W的最高价氧化物对应水化物的酸性依次降低 | |
| C. | WH4与Z元素的单质在一定条件下可能发生化学反应 | |
| D. | W的位置是第2周期、第ⅣA族 |