题目内容
6.W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )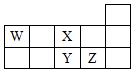
| A. | Z、Y、X的原子半径依次减小,非金属性依次降低 | |
| B. | Z、Y、W的最高价氧化物对应水化物的酸性依次降低 | |
| C. | WH4与Z元素的单质在一定条件下可能发生化学反应 | |
| D. | W的位置是第2周期、第ⅣA族 |
分析 W、X、Y、Z四种短周期元素,由它们在周期表中位置可知,W为C,X为O,Y为S,Z为Cl,
A.同周期从左向右原子半径减小,电子层越多原子半径越大;同主族从上到下非金属性减弱,同周期从左向右非金属性增强;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.WH4与Z元素的单质,在光照下可发生取代反应;
D.W为C元素.
解答 解:A.Y、Z、X的原子半径依次减小,非金属性X>Y、Z>Y,且O无正价,则非金属性X、Z、Y依次降低,故A错误;
B.非金属性Z>Y>W,则Z、Y、W的最高价氧化物对应水化物的酸性依次降低,故B正确;
C.WH4与Z元素的单质,在光照下可发生取代反应,生成卤代烃和HCl,故C正确;
D.W为C元素,位于第2周期、第ⅣA族,故D正确;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
16.下列说法正确的是( )
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
17.下列实验操作和现象及所得出的结论叙述正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| C | 向浓度均为0.1mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
11.可以将四种无色液体:C2H5OH、C2H5Br、苯、KI溶液一一区分开的试剂是( )
| A. | FeCl2溶液 | B. | 溴水 | C. | NaOH溶液 | D. | 水 |
1.由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:
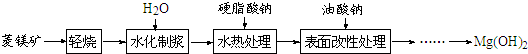
(1)从图1和图2可以得出的结论为随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加、温度升高,水化反应速率加快.

(2)水化反应MgO+H2O═Mg(OH)2能自发进行的原因是△H<0.
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等).(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
(4)已知热化学方程式:Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81.5kJ•mol-1
①Mg(OH)2起阻燃作用的主要原因是Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是无烟、无毒、腐蚀性小.

(1)从图1和图2可以得出的结论为随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加、温度升高,水化反应速率加快.

(2)水化反应MgO+H2O═Mg(OH)2能自发进行的原因是△H<0.
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等).(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
①Mg(OH)2起阻燃作用的主要原因是Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是无烟、无毒、腐蚀性小.
 .
.
 如图所示A是固体金属单质,燃烧时火焰呈黄色.
如图所示A是固体金属单质,燃烧时火焰呈黄色.