题目内容
12.四种短周期元素W、X、Y、Z的原子序数依次递增,可形成简单离子W2-、X+、Y3+、Z2-.下列说法不正确的是( )| A. | Y单质能溶于X元素的最高价氧化物的水化物 | |
| B. | W2能与H2Z发生置换反应 | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X形成两种离子化合物,阴、阳离子个数比一定是1:2 |
分析 四种短周期元素W、X、Y、Z的原子序数依次递增,可形成简单离子W2-、X+、Y3+、Z2-,则W、Z为第ⅥA元素,结合原子序数可知W为O,Z为S,则X、Y均为第三周期元素,结合电荷数等于族序数可知,X为Na,Y为Al,以此来解答.
解答 解:由上述分析可知,W为O,X为Na,Y为Al,Z为S,
A.Al与NaOH溶液反应生成偏铝酸钠和氢气,故A正确;
B.O2能与H2S发生置换反应生成S和水,故B正确;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径由大到小:Z2->W2->X+>Y3+,故C错误;
D.W、X形成两种离子化合物分别为Na2O、Na2O2,阴、阳离子个数比一定是1:2,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.自来水可以用氯气消毒,某学生用这种自来水配制下列物质溶液,不会产生明显的药品变质的是( )
| A. | AgNO3 | B. | NaOH | C. | Na2CO3 | D. | AlCl3 |
3.下列有关说法正确的是( )
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 乙烯和乙烷都能发生加聚反应 | |
| D. | 乙烯分子中所有原子不可能在同一平面内 |
20.下列化学用语正确的是( )
| A. | HCl的电子式 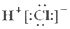 | B. | Cl-的结构示意图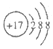 | ||
| C. | CO2的电子式 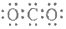 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
7.下列实验操作能达到目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
| C | 确定Na2SO3样品是否部分被氧化 | 取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成 |
| D | 检验乙醇发生消去反应生成 乙烯 | 将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
5.亚硝酞氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解.可用于合成清洁剂、触媒剂及中间体等.实验室可由氯气与一氧化氮在常温常压下合成.
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图1所示: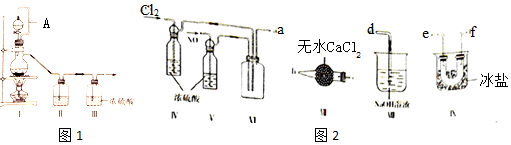
为制备纯净干燥的气体,表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图2所示:
①装置连接顺序为a→e→f(或f→e)→c→b→d (按气流自左向右方向,用小写字母表示).
②装置 IV、V 除可进一步干燥NO、Cl2外,另一个作用是观察气泡调节气体的流速.
③装置 VII的作用是防止水蒸气进入反应器.
④装置 VIII中吸收尾气时,NOCl发生反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O.
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酞氯和氯气,该反应的化学方程式为HNO3(浓)+3HC1(浓)=NOCl↑+Cl2↑+2H2O.
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图1所示:

为制备纯净干燥的气体,表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
①装置连接顺序为a→e→f(或f→e)→c→b→d (按气流自左向右方向,用小写字母表示).
②装置 IV、V 除可进一步干燥NO、Cl2外,另一个作用是观察气泡调节气体的流速.
③装置 VII的作用是防止水蒸气进入反应器.
④装置 VIII中吸收尾气时,NOCl发生反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O.
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酞氯和氯气,该反应的化学方程式为HNO3(浓)+3HC1(浓)=NOCl↑+Cl2↑+2H2O.
6.下列的电离方程式,正确的是( )
| A. | H2CO3?H2O+CO2↑ | B. | KOH═K++O2-+H+ | ||
| C. | HClO═H++ClO- | D. | Na2CO3═2Na++CO32- |
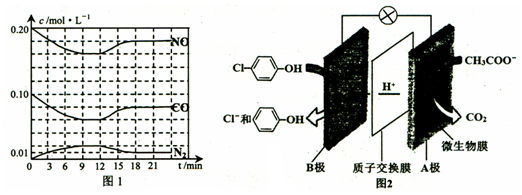
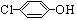 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.