题目内容
下表列出了①~⑥六种元素在元素周期表中的位置.
请回答下列问题:
(1)① ② (填写元素符号);
(2)元素②和⑥的氢化物中,稳定性较强的是 (填氢化物的分子式);
(3)④的最高价氧化物对应的水化物的化学式为 .
族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ |
(1)①
(2)元素②和⑥的氢化物中,稳定性较强的是
(3)④的最高价氧化物对应的水化物的化学式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥分别是C、O、F、Na、Al、S元素
(1)根据推断的元素书写元素符号;
(2)元素的非金属性越强,其氢化物越稳定;
(3)④的最高价氧化物对应的水化物是氢氧化钠.
(1)根据推断的元素书写元素符号;
(2)元素的非金属性越强,其氢化物越稳定;
(3)④的最高价氧化物对应的水化物是氢氧化钠.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥分别是C、O、F、Na、Al、S元素
(1)通过以上分析知,①是C、②是O元素,故答案为:C;O;
(2)同一主族元素中,元素的非金属性随着原子序数的增大而减弱,元素的非金属性越强,其氢化物越稳定,O元素的非金属性大于S元素,所以稳定性较强的是H2O,故答案为:H2O;
(3)④是Na元素,Na的最高价氧化物对应的水化物是氢氧化钠,其化学式为NaOH,故答案为:NaOH.
(1)通过以上分析知,①是C、②是O元素,故答案为:C;O;
(2)同一主族元素中,元素的非金属性随着原子序数的增大而减弱,元素的非金属性越强,其氢化物越稳定,O元素的非金属性大于S元素,所以稳定性较强的是H2O,故答案为:H2O;
(3)④是Na元素,Na的最高价氧化物对应的水化物是氢氧化钠,其化学式为NaOH,故答案为:NaOH.
点评:本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中的位置确定元素,再结合元素周期律来分析解答,熟练掌握元素周期律内涵及外延,灵活运用元素周期律解答问题,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各图示实验设计和操作合理的是( )
A、 证明非金属性强弱:S>C>Si |
B、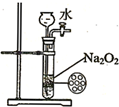 制备少量氧气 |
C、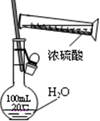 配制一定物质的量浓度的硫酸溶液 |
D、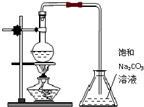 制备少量乙酸丁酯 |
常温下某H2CO3溶液的pH约为5.5,c(CO32-)约为5×10-11mol/L,该溶液中浓度最低的离子是( )
| A、HCO3- |
| B、CO32- |
| C、H+ |
| D、OH- |
下列化学用语中,表示正确的是( )
A、2s的电子云模型是: |
B、肽键的结构式为: |
C、H2S分子的球棍模型为: |
D、最外层电子排布式为ns2np3对应的轨道表示式为: |
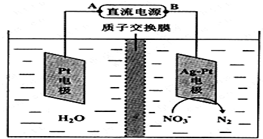 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示. 光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.