题目内容
 光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.(1)氯气工业上来源于氯碱工业,氯碱工业的化学方程式为
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,则该反应的热化学方程式为:
(3)COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ/mol.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未标出):
①计算反应在第8min时的平衡常数K=
②比较第2min反应温度T(2)与第8min反应温度(T8)的高低:T(2)
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=
④比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以V(2-3)、V(5-6)、V(l2-13)表示]的大小
⑤反应物COCl2在5-6min和15-16min时平均反应速率的大小为:V(5-6)>V(15-16),原因是
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)用惰性电极电解饱和氯化钠溶液,阳极上氯离子放电、阴极上氢离子放电;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式;
(3)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式;
(3)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
| c(CO).c(Cl2) |
| c(COCl2) |
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答:
解:(1)用惰性电极电解饱和氯化钠溶液,阳极上氯离子放电、阴极上氢离子放电,电池反应式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1;
(3)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
=
=0.23,故答案为:0.23;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
=0.23,解得c(COCl2)=0.031mol/L,故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),故答案为:在相同温度时,该反应的反应物的浓度越高,反应速率越大.
| ||
| ||
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1;
(3)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
| c(CO).c(Cl2) |
| c(COCl2) |
| 0.085×0.11 |
| 0.04 |
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
| 0.06×0.12 |
| c(COCl2) |
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),故答案为:在相同温度时,该反应的反应物的浓度越高,反应速率越大.
点评:本题考查较综合,涉及电解原理、盖斯定律、化学平衡移动等知识点,难点是化学平衡常数的有关计算,理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,再结合平衡常数公式进行计算,题目难度中等.

练习册系列答案
相关题目
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| A、MgSO4,CuSO4 |
| B、AgNO3,Pb(NO3)2 |
| C、FeSO4,Al2 (SO4)3 |
| D、CuSO4,AgNO3 |

 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: 石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类.蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途.
石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类.蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途.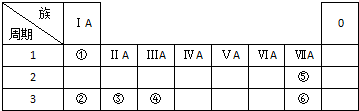 下表列出了①~⑥六种元素在周期表中的位置.
下表列出了①~⑥六种元素在周期表中的位置.