题目内容
氮化铝(AlN)是一种新型无机非金属材料.某AlN样品仅含有A12O3杂质,为测定AlN的含量,设计如下三种实验方案.(已知:A1N+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
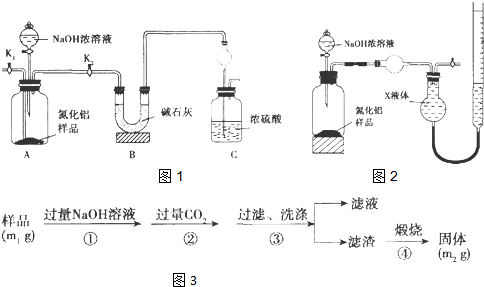
(1)装置图1中球形干燥管的作用是 .
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品.接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是 .
(3)由于装置存在缺陷,导致测定结果偏高.请提出改进意见 .
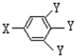
【方案2】用装置图2测定mg样品中AlN的纯度(部分夹持装置已略去).
(4)为测定生成气体的体积,量气装置中的X液体可以是 .
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况).则AlN的质量分数是 .
【方案3】按如图3步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为 .
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”).
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).

(1)装置图1中球形干燥管的作用是
(2)完成以下实验步骤:组装好实验装置,首先
(3)由于装置存在缺陷,导致测定结果偏高.请提出改进意见
【方案2】用装置图2测定mg样品中AlN的纯度(部分夹持装置已略去).
(4)为测定生成气体的体积,量气装置中的X液体可以是
a.CCl4 b.H2O c.NH4Cl溶液 d.

(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况).则AlN的质量分数是
【方案3】按如图3步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为
(7)若在步骤③中未洗涤,测定结果将
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:【方案l】测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量.
(1)分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
【方案2】测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的体积来计算氮化铝的含量.
(4)依据氨气极易溶于水的性质分析判断;
(5)依据化学方程式定量关系计算得到;
【方案3】测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量.
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成;
(7)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高.
(1)分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
【方案2】测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的体积来计算氮化铝的含量.
(4)依据氨气极易溶于水的性质分析判断;
(5)依据化学方程式定量关系计算得到;
【方案3】测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量.
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成;
(7)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高.
解答:
解:(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性,关闭K1,打开K2,把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,故答案为:C装置出口处连接一个干燥装置;
(4)依据氨气极易溶于水的性质分析,为测定生成气体的体积,量气装置中的X液体可以是;
a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确;
故答案为:ad.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AIN+NaOH+H2O═NaAIO2+NH3↑
41g 22.4L
m V×10-3L
m=
则AlN的质量分数=
×100%=
×100%,
故答案为:
×100%;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(7)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高.
故答案为:防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性,关闭K1,打开K2,把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,故答案为:C装置出口处连接一个干燥装置;
(4)依据氨气极易溶于水的性质分析,为测定生成气体的体积,量气装置中的X液体可以是;
a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确;
故答案为:ad.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AIN+NaOH+H2O═NaAIO2+NH3↑
41g 22.4L
m V×10-3L
m=
| 41g×V×10-3L |
| 22.4L |
则AlN的质量分数=
| ||
| m |
| 41V |
| 22400m |
故答案为:
| 41V |
| 22400m |
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(7)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高.
点评:本题考查了物质性质的探究实验设计和氮化铝含量的测定,实验基本操作和物质性质的掌握是关键,题目难度中等.

练习册系列答案
相关题目
将氯气通入含有大量下列离子的各组溶液中,无任何现象发生的是( )
| A、Na+、H+、SO42- |
| B、H+、Ag+、NO3- |
| C、K+、HCO3-、Cl- |
| D、Na+、NO3-、Fe2+ |

 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)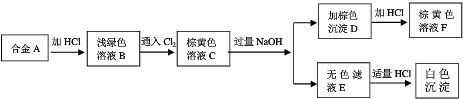

 ,则其单体的结构简式为
,则其单体的结构简式为