题目内容
将2.7g铝溶解于100mL 3mol/L氢氧化钠,然后向所得溶液中加入400mL 1mol/L的盐酸最后可得沉淀多少g.
考点:化学方程式的有关计算
专题:计算题
分析:金属铝溶于氢氧化钠发生反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,在加入盐酸,先是会和剩余的盐酸反应:NaOH+HCl=NaCl+H2O,然后是:H2O+NaAlO2+HCl=NaCl+Al(OH)3↓,若盐酸再剩余,则盐酸会将沉淀溶解,即:3HCl+Al(OH)3=AlCl3+3H2O,据此进行计算即可.
解答:
解:金属铝2.7g即0.1mol和氢氧化钠的反应为:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
2 2 2
0.1mol 0.1mol 0.1mol
溶解金属铝后剩余的氢氧化钠是:0.1L×3mol/L-0.1mol=0.2mol,再加入盐酸,先是和氢氧化钠反应:
NaOH+HCl=NaCl+H2O
0.2mol 0.2mol
然后剩余的盐酸发生反应:H2O+NaAlO2+HCl=NaCl+Al(OH)3↓
0.1mol 0.1mol 0.1mol
还会剩余盐酸0.1mol,最后的反应是:
3HCl+Al(OH)3=AlCl3+3H2O
3 1
0.1
最后可得沉淀氢氧化铝的质量是(0.1mol-
)×78g/mol=5.2g.
答:最后可得沉淀5.2g.
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
2 2 2
0.1mol 0.1mol 0.1mol
溶解金属铝后剩余的氢氧化钠是:0.1L×3mol/L-0.1mol=0.2mol,再加入盐酸,先是和氢氧化钠反应:
NaOH+HCl=NaCl+H2O
0.2mol 0.2mol
然后剩余的盐酸发生反应:H2O+NaAlO2+HCl=NaCl+Al(OH)3↓
0.1mol 0.1mol 0.1mol
还会剩余盐酸0.1mol,最后的反应是:
3HCl+Al(OH)3=AlCl3+3H2O
3 1
0.1
| 0.1mol |
| 3 |
最后可得沉淀氢氧化铝的质量是(0.1mol-
| 0.1mol |
| 3 |
答:最后可得沉淀5.2g.
点评:本题考查学生利用化学反应方程式的计算,明确铝与酸、碱反应的化学反应方程式,酸是解答本题的关键.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
生活中常用到一些化学物质,下列物质与对应的用途错误的是( )
| A、CaO--干燥剂 |
| B、Na2O2--供氧剂 |
| C、Al2O3--铝热剂 |
| D、KAl(SO4)2.12H2O--净水剂 |
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”.稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法正确的是( )
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
下列关于试剂保存正确的是( )
| A、用无色玻璃试剂瓶保存氯水 |
| B、用玻璃瓶保存氢氟酸 |
| C、NaOH溶液保存在带玻璃塞的广口瓶中 |
| D、硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |

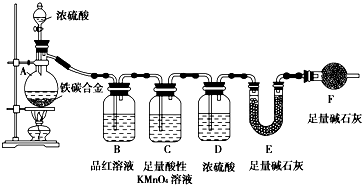 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置: