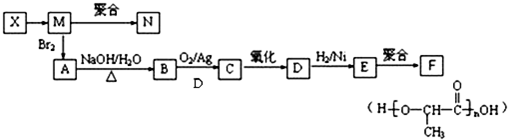
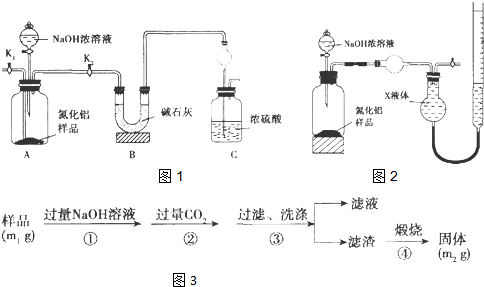
题目内容
已知KSP(Cu(OH)2)=2.2×10-20,在1mol/L的CuCl2溶液中不断加入氨水,试计算:
(1)Cu2+开始沉淀时溶液的pH
(2)Cu2+完全沉淀时溶液的pH(当c(Cu2+)小于10-5mol/L时,认为沉淀完全)
(1)Cu2+开始沉淀时溶液的pH
(2)Cu2+完全沉淀时溶液的pH(当c(Cu2+)小于10-5mol/L时,认为沉淀完全)
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:当生成沉淀时,应满足Qc>KSP(Cu(OH)2),Cu2+完全沉淀时,c(Cu2+)小于10-5mol/L,根据Ksp=(Cu2+)×c2(OH-)计算该题.
解答:
解:(1)在1mol/L的CuCl2溶液中不断加入氨水,Cu2+开始沉淀时,应满足(Cu2+)×c2(OH-)≥Ksp=2.2×10-20,c(OH-)≥
mol/L=1.48×10-10mol/L,
c(H+)=
mol/L=6.8×10-5mol/L
pH=4.2,
答:Cu2+开始沉淀时溶液的pH为4.2;
(2)Cu2+完全沉淀时,c(Cu2+)小于10-5mol/L,c(OH-)≥
mol/L=4.69×10-8mol/L,c(H+)=
mol/L=2.13×10-7mol/L,pH=6.7,
答:Cu2+完全沉淀时溶液的pH为6.7.
|
c(H+)=
| 10-14 |
| 1.48×10-10 |
pH=4.2,
答:Cu2+开始沉淀时溶液的pH为4.2;
(2)Cu2+完全沉淀时,c(Cu2+)小于10-5mol/L,c(OH-)≥
|
| 10-14 |
| 4.69×10-8 |
答:Cu2+完全沉淀时溶液的pH为6.7.
点评:本题考查难溶电解质的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用即可解答该题,难度不大.

练习册系列答案
相关题目
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”.稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法正确的是( )
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、Na2CO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、25℃,pH=7的NH3?H2O和NH4Cl的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| C、CH3COONa溶液中:c(Na+)>c(CH3COO -)>c(H+)>c(OH-) |
| D、NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-) |
用石墨作电极电解下列物质的水溶液,一段时间后,溶液pH增大的是( )
| A、NaCl |
| B、Na2SO4 |
| C、CuSO4 |
| D、H2SO4 |