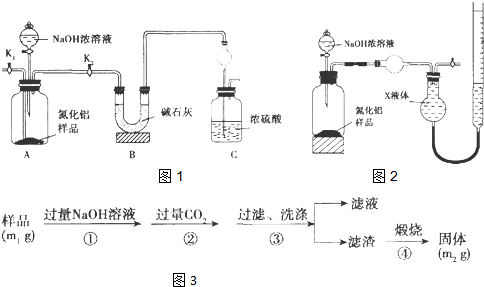
题目内容
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na).谷氨酸钠有鲜味,易溶于水.某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”.某学校化学科研小组现对此味精中NaCl的含量进行测定.
Ⅰ.查阅资料:资料表明:谷氨酸钠的存在不影响NaCl含量进行测定.
Ⅱ.设计实验方案:
(1)实验试剂:水、试剂X的溶液等
(2)实验过程:

根据上述实验步骤回答下列有关问题:(第③④问写出必要的计算过程)
①加入的试剂X为 ,操作(2)的名称为: .
②通过计算判断该味精中NaCl的质量分数,是否符合其包装上标注的标准.
③计算实验操作(1)所得溶液为50mL,则溶液A中Na+的物质的量浓度是多少?
Ⅰ.查阅资料:资料表明:谷氨酸钠的存在不影响NaCl含量进行测定.
Ⅱ.设计实验方案:
(1)实验试剂:水、试剂X的溶液等
(2)实验过程:

根据上述实验步骤回答下列有关问题:(第③④问写出必要的计算过程)
①加入的试剂X为
②通过计算判断该味精中NaCl的质量分数,是否符合其包装上标注的标准.
③计算实验操作(1)所得溶液为50mL,则溶液A中Na+的物质的量浓度是多少?
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:味精试样加入水溶解得到溶液A,加入硝酸银溶液完全沉淀氯离子,得到氯化银沉淀过滤洗涤烘干称量得到氯化银质量,结合氯元素守恒计算;
①分析流程图结合实验目的,测定味精中NaCl的含量,需要加入过量硝酸银溶液沉淀氯离子;操作(2)是对沉淀进行洗涤,减小测定误差;
②依据元素守恒计算氯化钠的含量和标准NaCl含量≤20%”比较分析判断;
③依据沉淀质量计算物质的量根据氯元素守恒得到氯化钠物质的量,依据c=
计算得到溶液浓度;
①分析流程图结合实验目的,测定味精中NaCl的含量,需要加入过量硝酸银溶液沉淀氯离子;操作(2)是对沉淀进行洗涤,减小测定误差;
②依据元素守恒计算氯化钠的含量和标准NaCl含量≤20%”比较分析判断;
③依据沉淀质量计算物质的量根据氯元素守恒得到氯化钠物质的量,依据c=
| n |
| V |
解答:
解:①味精样品溶解后,加入过量硝酸银使氯化钠中的氯离子全部沉淀,过滤洗涤后称量沉淀质量计算氯化钠含量,所以X为硝酸银溶液目的是为了沉淀氯离子;操作(2)是对沉淀进行洗涤,洗去沉淀表面的杂质离子,使测定结果更准确;
故答案为:AgNO3;洗涤;
②故答案为:④流程分析,生成的氯化银沉淀质量2.87g,物质的量=
=0.02mol,则样品中氯化钠物质的量为2mol,质量分数=
×100%=23.4%>20%,所以味精中NaCl的质量分数不符合其包装上标注的标准;
答:不符合其包装上标注的标准;
③依据上述计算可知A溶液中含有氯化钠物质的量为0.02mol,溶液A为50mL,则溶液A中NaCl的物质的量浓度=
=0.4mol/L;
答:如果溶液A为50mL,则溶液A中NaCl的物质的量浓度是0.4mol/L;
故答案为:AgNO3;洗涤;
②故答案为:④流程分析,生成的氯化银沉淀质量2.87g,物质的量=
| 2.87g |
| 143.5g/mol |
| 0.02mol×58.5g/mol |
| 5.0g |
答:不符合其包装上标注的标准;
③依据上述计算可知A溶液中含有氯化钠物质的量为0.02mol,溶液A为50mL,则溶液A中NaCl的物质的量浓度=
| 0.02mol |
| 0.05L |
答:如果溶液A为50mL,则溶液A中NaCl的物质的量浓度是0.4mol/L;
点评:本题考查了物质组成的实验测定实验设计和计算应用,主要是实验基本操作的应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
生活中常用到一些化学物质,下列物质与对应的用途错误的是( )
| A、CaO--干燥剂 |
| B、Na2O2--供氧剂 |
| C、Al2O3--铝热剂 |
| D、KAl(SO4)2.12H2O--净水剂 |
某酯完全燃烧生成等物质的量的CO2和H2O,如该酯水解可得羧酸B和醇C,把醇C氧化可得羧酸D.且B与D互为同分异构体,则该酯可能为( )
| A、CH3CH2CH2COOCH2CH(CH3)2 |
| B、CH3 COOCH(CH3)2 |
| C、CH3 COOCH2CH2CH2OOCCH3 |
| D、CH3 COOCH2CH3 |
下列是一些制取物质的设计或设想,其中违背科学原理的是( )
| A、以油脂为原料提取甘油,用作护肤品中的保湿剂 |
| B、以动物的毛发为原料提取氨基酸 |
| C、以淀粉作原料提取淀粉酶,用作催化剂 |
| D、以棉花为原料制备火棉和胶棉 |
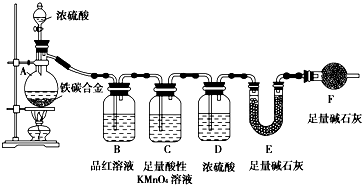 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置: