题目内容
A为两种金属组成的合金,发生如图化学变化,其中白色沉淀G不溶于氨水,试回答下列问题:
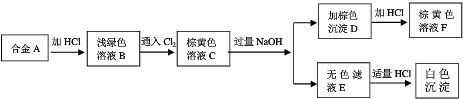
(1)组成合金A的元素名称是 和 ;
(2)写出下列变化的离子方程式:
C→E ;D→F ;
(3)若有8.3g的合金A溶解,最多得到7.8g的沉淀G,则合金中两种金属的物质的量之比为 .

(1)组成合金A的元素名称是
(2)写出下列变化的离子方程式:
C→E
(3)若有8.3g的合金A溶解,最多得到7.8g的沉淀G,则合金中两种金属的物质的量之比为
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:含Fe2+溶液是浅绿色的,能被氯气氧化为Fe3+,Al可以和盐酸反应得到可溶性的含有Al3+的盐,铝离子和过量的NaOH反应会生成偏铝酸钠的水溶液,向其中加盐酸会出现氢氧化铝沉淀,所以可以确定A为铁铝合金,B为含Fe2+溶液,C为含Fe3+溶液,D为Fe(OH)3,E为NaAlO2,F为FeCl3,白色沉淀G为Al(OH)3,据此答题;
解答:
解:含Fe2+溶液是浅绿色的,能被氯气氧化为Fe3+,Al可以和盐酸反应得到可溶性的含有Al3+的盐,铝离子和过量的NaOH反应会生成偏铝酸钠的水溶液,向其中加盐酸会出现氢氧化铝沉淀,所以可以确定A为铁铝合金,B为含Fe2+溶液,C为含Fe3+溶液,D为Fe(OH)3,E为NaAlO2,F为FeCl3,白色沉淀G为Al(OH)3,
(1)合金是金属铁和铝的合金,
故答案为:铁;铝;
(2)氯化铝和过量的氢氧化钠反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,氢氧化铁溶于盐酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Al3++4OH-═AlO2-+2H2O,Fe(OH)3+3H+=Fe3++3H2O;
(3)若有8.3g的合金A溶解,最多得到7.8g的沉淀Al(OH)3,根据元素守恒,铝的物质的量为
mol=0.1mol,则合金中铁的质量为8.3g-0.1×27g=5.6g,所以物质的量为
mol=0.1mol,所以两种金属的物质的量之比为1:1,
故答案为:1:1;
(1)合金是金属铁和铝的合金,
故答案为:铁;铝;
(2)氯化铝和过量的氢氧化钠反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,氢氧化铁溶于盐酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Al3++4OH-═AlO2-+2H2O,Fe(OH)3+3H+=Fe3++3H2O;
(3)若有8.3g的合金A溶解,最多得到7.8g的沉淀Al(OH)3,根据元素守恒,铝的物质的量为
| 7.8 |
| 78 |
| 5.6 |
| 56 |
故答案为:1:1;
点评:本题考查了离子方程式书写和化学计算,解题的关键在于物质的推断,难度中等,答题时注意根据物质常见性质判断物质种类.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
表示下列变化的化学用语正确的是( )
| A、NaHCO3的水解:HCO3-+H2O?H3O++CO32- | ||||
| B、1L 0.5mol?L-1稀硫酸与1L 1mol?L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(1);△H=-57.3 kJ/mol | ||||
| C、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | ||||
D、以惰性电极电解KCl溶液:2Cl-+2H2O
|
生活中常用到一些化学物质,下列物质与对应的用途错误的是( )
| A、CaO--干燥剂 |
| B、Na2O2--供氧剂 |
| C、Al2O3--铝热剂 |
| D、KAl(SO4)2.12H2O--净水剂 |
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”.稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法正确的是( )
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |


 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下: