题目内容
13.根据信息回答下列问题:信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
分析 (1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg;
(2)同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小;
(3)图中第一电离能最小的元素是铷,在第五周期ⅠA族;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物;
(5)运用电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小;
(6)电负性与元素性质的关系:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)注意判断共价化合物的依据:两元素的电负性差值若小于1.7,形成共价键;若电负性的差值大于1.7,则形成离子键.
解答 解:(1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg,
故答案为:Na、Mg;
(2)同一主族元素原子的从上到下,金属性增强,容易失去电子,所以第一电离能I1变化规律是从上到下逐渐减小,
故答案为:从上到下依次减小;
(3)金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期IA族,
故答案为:五;IA;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物,都能与酸反应生成盐和水,也都能与强碱反应生成盐和水,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO2-+2H2O;
故答案为:两;Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO2-+2H2O.
(5)根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,可知,在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,最小范围应为0.93~1.57,
故答案为:0.93~1.57;
(6)因电负性可以用来衡量原子吸引电子能力的大小,所以电负性越大,原子吸引电子的能力越强,非金属性越强,反之金属性越强,
故答案为:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)AlCl3中Al与Cl的电负性差值为1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlCl3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电,
故答案为:Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
点评 本题考查了第一电离能的变化趋势、电离能的综合应用,题目难度中等,注意“同一周期元素中,元素第一电离能的变化趋势,及异常现象”,为易错点.

 习题精选系列答案
习题精选系列答案| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-) | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) |
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ,⑧
,⑧
(2)第三周期(除稀有气体元素)中原子半径最大的元素是③(填序号),跟它同周期原子半径最小的元素是⑧(填序号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)写出实验室制取元素①的气态氢化物最常用的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)元素①的最高价氧化物对应的水化物的浓溶液与单质铜反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |

| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
| A. | 有机物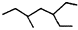 的系统命名为:3-乙基-5-甲基庚烷 的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 | |
| C. | 等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 糖类、油脂、蛋白质都属于天然有机高分子化合物,都能发生水解反应 |