题目内容
18.下列有关如图装置的说法正确的是( )
| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
分析 A、若K与c连接,是原电池,石墨电极是正极,电极反应为:O2+4e-+2H2O=4OH-;
B、若K与c连接,是原电池,原电池中的Na+向正极移动;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H++2e-═H2↑;
D、若K与d连接,一段时间后是电解饱和食盐水,产生氢气和氯气,所以加入氯化氢气体可使电解质溶液复原.
解答 解:A、若K与c连接,是原电池,石墨电极是正极,是吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH-,故A错误;
B、若K与c连接,是原电池,原电池中的Na+向正极移动,所以钠离子向石墨极移动,故B错误;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H++2e-═H2↑,故C正确;
D、若K与d连接,一段时间后是电解饱和食盐水,产生氢气和氯气,所以加入氯化氢气体可使电解质溶液复原,而不是深度电解,故D错误;
故选C.
点评 本题考查原电池与电解原理,难度不大,电化学的有关知识一直是高考考查的重点,原电池与电解池的本质都是氧化还原反应,注意掌握电解池中离子放电顺序.

练习册系列答案
相关题目
2.下列有关物质的性质与用途具有对应关系的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3受热易分解,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3熔点高,可用作耐高温材料 |
6.下列物质:①Cl2 ②HBr ③H2O ④H2,其中在一定条件下能与乙烯发生加成反应的是( )
| A. | ①② | B. | ③④ | C. | ①③④ | D. | 全部 |
13.根据信息回答下列问题:
信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
(1)认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为Na<Al<Mg(填元素符号).
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
10.X、Y、Z、W是原子序数逐渐增大的四种短周期主族元素,其原子半径如下表,已知Y、Z两种元素的单质是空气主要成分,W原子最外层电子数与Ne原子最外层电子数相差1.下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |
7.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小的是A.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.

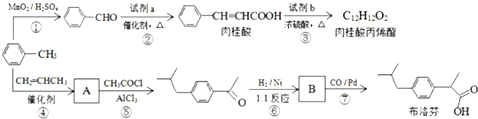
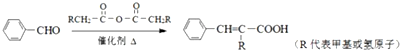
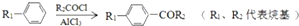
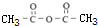 ;
;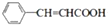 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$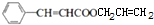 +H2O;
+H2O; ;
;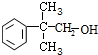 .
.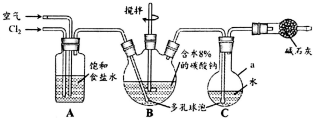 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.