题目内容
同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是( )
| A、反应速率HCl>CH3COOH |
| B、气泡逸出速率CH3COOH>HCl |
| C、在相同条件下两酸产生的CO2的体积不相同 |
| D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:盐酸是强酸,能够完全电离,醋酸是弱酸,不能完全电离,所以相同浓度的两种酸,盐酸中所含氢离子浓度大,醋酸所含氢离子浓度小,醋酸在水溶液中主要以分子形式存在,醋酸的酸性强于碳酸,能够与Na2CO3反应生成二氧化碳气体,同物质的量浓度、同体积的HCl和醋酸溶液,与过量相同情况的Na2CO3固体反应时,生成的二氧化碳气体物质的量相同,据此分析.
解答:
解:盐酸是强酸,能够完全电离,醋酸是弱酸,不能完全电离,所以相同浓度的两种酸,盐酸中所含氢离子浓度大,醋酸所含氢离子浓度小,醋酸在水溶液中主要以分子形式存在,醋酸的酸性强于碳酸,能够与Na2CO3反应生成二氧化碳气体,同物质的量浓度、同体积的HCl和醋酸溶液,与过量相同情况的Na2CO3固体反应时,生成的二氧化碳气体物质的量相同,
A、盐酸中氢离子浓度大,开始反应速率快,故A正确;
B、盐酸中氢离子浓度大,开始反应速率快,气泡逸出速率快,故B错误;
C、同物质的量浓度、同体积的HCl和醋酸溶液,与过量相同情况的Na2CO3固体反应时,生成的二氧化碳气体物质的量相同,故C错误;
D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl<CH3COOH,故D错误;
故选A.
A、盐酸中氢离子浓度大,开始反应速率快,故A正确;
B、盐酸中氢离子浓度大,开始反应速率快,气泡逸出速率快,故B错误;
C、同物质的量浓度、同体积的HCl和醋酸溶液,与过量相同情况的Na2CO3固体反应时,生成的二氧化碳气体物质的量相同,故C错误;
D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl<CH3COOH,故D错误;
故选A.
点评:本题考查了弱电解质的电离平衡的应用,强弱电解质与等量物质反应时物质的量的判断,注意弱酸存在电离平衡,反应过程中会继续电离.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该有机物属于烃 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、无色溶液:Ca2+、H+、Cl-、HSO3 - | ||
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 - | ||
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3 - | ||
D、
|
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② |
| D、NaHCO3溶液中:c(Na+)>c( HCO3-)>c(OH-)>c(H+)>c(CO32-) |
 如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度
如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线.下列有关该反应的描述正确的是( )
| A、该反应的过程是熵减小的过程 |
| B、若降低温度,v正减小,v逆增大 |
| C、第6min后,反应就停止了 |
| D、X在第一分钟和第二分钟内的平均反应速率之比是3:2 |
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
| A、此反应物的总能量低于生成物的总能量 |
| B、反应达到平衡后,3ν正(NH3)=2ν逆(H2O) |
| C、其它条件不变,温度越高,氨的转化率越高 |
| D、寻找合适的催化剂是加快反应速率的有效措施 |
下列各组离子在指定溶液中能大量共存的是( )
| A、滴入甲基橙显红色的溶液中:K+、Al3+、I-、ClO-、NO3- |
| B、常温下,某溶液pH=1的溶液中含有:NO3-、NH4+、Fe2+、SO42- |
| C、常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
| D、0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol?L-1NaCl溶液含有NA个Na+ |
| B、1.0L浓度为18mol?L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA |
| C、在酸性条件下,1molFe2+与足量的H2O2溶液反应,转移2NA个电子 |
| D、1molNa与足量O2在一定条件下反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
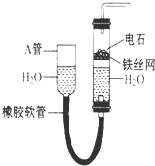 如图中的实验装置可以用于实验室制取乙炔.请填空.
如图中的实验装置可以用于实验室制取乙炔.请填空.