题目内容
下列各组离子在指定溶液中能大量共存的是( )
| A、滴入甲基橙显红色的溶液中:K+、Al3+、I-、ClO-、NO3- |
| B、常温下,某溶液pH=1的溶液中含有:NO3-、NH4+、Fe2+、SO42- |
| C、常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
| D、0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
考点:离子共存问题
专题:
分析:A.滴入甲基橙显红色的溶液为酸性溶液,酸性条件下次氯酸根离子、硝酸根离子能够氧化碘离子,次氯酸根离子与铝离子发生双水解反应;
B.常温下,某溶液pH=1的溶液中氢离子浓度为0.1mol/L,硝酸根离子在酸性条件下能够氧化亚铁;
C.常温下,c(H+)/c(OH-)=1×10-12的溶液中氢氧根离子浓度为0.1mol/L,K+、AlO2-、CO32-、Na+离子之间不发生反应,都不与氢氧根离子反应;
D.铁离子与硫氢根离子反应生成硫氰化铁.
B.常温下,某溶液pH=1的溶液中氢离子浓度为0.1mol/L,硝酸根离子在酸性条件下能够氧化亚铁;
C.常温下,c(H+)/c(OH-)=1×10-12的溶液中氢氧根离子浓度为0.1mol/L,K+、AlO2-、CO32-、Na+离子之间不发生反应,都不与氢氧根离子反应;
D.铁离子与硫氢根离子反应生成硫氰化铁.
解答:
解:A.滴入甲基橙显红色的溶液中存在大量氢离子,ClO-离子氧化I-,NO3-在酸性条件下能够氧化I-,Al3+、ClO-、之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.常温下,某溶液pH=1的溶液中含有大量氢离子,NO3-在酸性条件下能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.常温下,c(H+)/c(OH-)=1×10-12的溶液为碱性溶液,K+、AlO2-、CO32-、Na+离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.Fe3+和 SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故D错误;
故选C.
B.常温下,某溶液pH=1的溶液中含有大量氢离子,NO3-在酸性条件下能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.常温下,c(H+)/c(OH-)=1×10-12的溶液为碱性溶液,K+、AlO2-、CO32-、Na+离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.Fe3+和 SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是( )
| A、反应速率HCl>CH3COOH |
| B、气泡逸出速率CH3COOH>HCl |
| C、在相同条件下两酸产生的CO2的体积不相同 |
| D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH |
从利用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序主要跟下列有关的是( )
①地壳中金属元素的含量;
②金属活动性顺序;
③金属的导电性;
④金属冶炼的难易程度.
①地壳中金属元素的含量;
②金属活动性顺序;
③金属的导电性;
④金属冶炼的难易程度.
| A、①③ | B、②④ | C、③⑤ | D、②⑤ |
铜片和锌片用导线连接后插入稀硫酸中构成原电池,正确的是( )
| A、铜片做负极发生氧化反应 |
| B、锌片做负极发生氧化反应 |
| C、铜片做阳极发生还原反应 |
| D、锌片做阴极发生还原反应 |
下列说法或表示法正确的是( )
| A、1mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| D、在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧产生的热量不相等 |
下列沸点最高的是( )
| A、正戊烷 | B、异戊烷 |
| C、丁烷 | D、丙烷 |
下列过程属于熵增加的是( )
| A、一定条件下,水由气态变为液态 |
| B、2H2(g)+O2(g)═2H2O(g) |
| C、HCl(g)+NH3(g)═NH4Cl(s) |
| D、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) |
已知阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量有( )
| A、1摩尔水的质量 |
| B、1摩尔水蒸气的质量 |
| C、1摩尔水的体积 |
| D、1摩尔水蒸气的体积 |
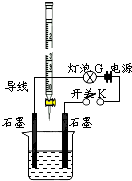 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.