题目内容
14.过渡元素及其化合物具有广泛的用途.(1)三硝酸六尿素合铁{[Fe(H2NCONH2)6](NO3)3}是一种有机铁肥.1mol H2NCONH2中含有的σ键的数目是7NA;与NO3-互为等电子体的一种分子是SO3(填化学式).
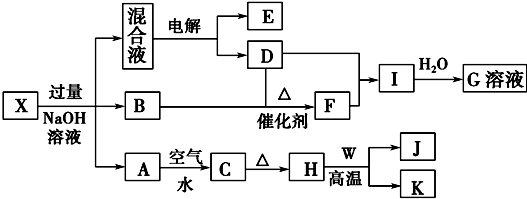
(2)氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,其晶胞结构如图1,该晶胞中每个Cu+的配位数与含有的Cl-的个数之比为1:1;铜的第一电离能(I1)小于锌的第一电离能,其主要原因是Cu失去一个电子时,核外电子排布从[Ar]3d104s1变为[Ar]3d10能量较低的稳定结构较容易,Zn失去一个电子时,核外电子排布从[Ar]3d104s2变为[Ar]3d104s1较难.
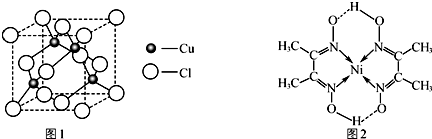
(3)丁二酮肟镍是一种鲜红色沉淀,可用来检验Ni2+,其分子结构如图2.该结构中C原子的杂化方式是sp2、sp3,分子内微粒之间存在的作用力有bcd(填字母).
a.离子键 b.共价键 c.配位键 d.氢键.
分析 (1)1molH2NCONH2中含有7molσ键和1molπ键;原子总数相等,价电子总数相等的微粒为等电子体,利用代换法书写;
(2)氯化亚铜(CuCl)晶胞中每个Cu+的配位数为4,含有的Cl-的个数为4;Cu失去一个电子时,能量减小,变成稳定状态,Zn失去一个电子时,变成不稳定状态;
(3)根据杂化轨道理论及丁二酮肟中碳原子的成键情况,可知碳原子的杂化方式;双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;丁二酮肟中碳原子既有单键又有双键.
解答 解:(1)1molH2NCONH2中含有7NA个lσ键和NA个π键.N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体,
故答案为:7NA;SO3;
(2)氯化亚铜(CuCl)晶胞中每个Cu+的配位数为4,含有的Cl-的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故每个Cu+的配位数与含有的Cl-的个数之比为1:1.Cu失去一个电子时,核外电子排布从[Ar]3d104s1变为[Ar]3d10能量较低的稳定结构较容易;Zn失去一个电子时,核外电子排布从[Ar]3d104s2变为[Ar]3d104s1较难,
故答案为:1:1;Cu失去一个电子时,核外电子排布从[Ar]3d104s1变为[Ar]3d10能量较低的稳定结构较容易,Zn失去一个电子时,核外电子排布从[Ar]3d104s2变为[Ar]3d104s1较难;
(3)因为在丁二酮肟中有两种碳原子,一种是甲基中的碳是按sp3杂化,另一种碳与氮形成双键的,是按sp2方式杂化.
双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键.氧原子与氢原子之间可以形成氢键.在该结构中碳原子既有单键又有双键,
故答案为:sp2、sp3;bcd.
点评 本题考查了价电子排布、原子杂化方式、分子间作用力、配合物的结构等知识,有一定的综合性,中等难度,注意基础知识的运用.

| A. | 5.6g铁与足量稀硝酸反应,转移电子的数目为0.2NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4NA | |
| D. | 1L 0.1mol•L-1氯化铜溶液中铜离子数为0.1NA |
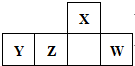 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是( )| A. | 最简单气态氢化物的热稳定性:X>Z | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | 原子半径:Y>Z>X | |
| D. | 含Y的盐溶液一定呈酸性 |
| A. | 原子半径大小顺序:X>Z>W>Y | |
| B. | 氢化物的沸点高低顺序:Z>W | |
| C. | 元素非金属性强弱顺序:W>Z>Y | |
| D. | 化合物XW与XW2中化学键类型完全相同 |
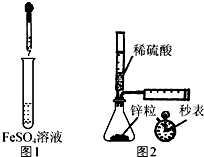
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤 | |
| D. | 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象 |
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]沉淀,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
| A. | 卤素元素最外层电子数都是7个,单质化学性质均较稳定 | |
| B. | 卤素元素的单质从上到下熔、沸点依次升高 | |
| C. | 卤素元素的单质从上到下颜色逐渐变浅 | |
| D. | 卤素元素从上到下随电子层数的增多非金属性也依次增强 |