题目内容
5.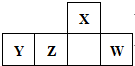 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是( )| A. | 最简单气态氢化物的热稳定性:X>Z | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | 原子半径:Y>Z>X | |
| D. | 含Y的盐溶液一定呈酸性 |
分析 短周期元素X、Y、Z、W在周期表中的位置如图所示,结合元素周期表结构可知,X处于第二周期,Y、Z、W处于第三周期;Y所处的周期数和族序数相等,则Y处于ⅢA族,为Al元素;结合各元素的相对位置可知,Z为Si、X为N、W为S元素,结合元素周期律的知识进行判断.
解答 解:短周期元素X、Y、Z、W在周期表中的位置如图所示,结合元素周期表结构可知,X处于第二周期,Y、Z、W处于第三周期;Y所处的周期数和族序数相等,则Y处于ⅢA族,为Al元素;结合各元素的相对位置可知,Z为Si、X为N、W为S元素,
A.Z为Si、X为N,非金属性:N>Si,则最简单气态氢化物的热稳定性:X>Z,故A正确;
B.Z为Si、W为S元素,非金属性:Si<S,最高价氧化物对应水化物的酸性:Z<W,故B正确;
C.电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则原子半径大小为:Y>Z>X,故C正确;
D.Y为Al元素,偏铝酸钠为Al的盐溶液,但偏铝酸钠呈碱性,故D错误;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
16.有机物甲、乙的结构如图所示.下列说法错误的是( )
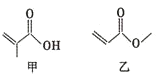
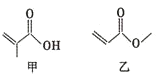
| A. | 甲、乙互为同分异构体 | |
| B. | 一定条件下,甲、乙均能发生取代反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 甲、乙都能使酸性KMnO4溶液褪色 |
20.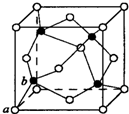 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
(1)已知CA5为离子化合物,写出其电子式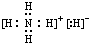 .
.
(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子,该分子中σ键和π键的个数比为1:1.
(3)画出D基态原子的核外电子排布图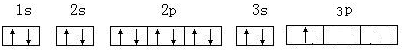 .
.
(4)C与A形成最简单化合物的沸点高于E与A形成的化合物,其原因是NH3分子之间可以形成氢键.
(5)EF3中心原子的杂化方式为sp3;用价层电子对互斥理论推测其空间构型为三角锥形.
(6)检验G元素的方法是焰色反应;请用原子结构的知识解释产生此现象的原因当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量.
(7)H与硫元素形成的化合物HS的晶体结构如图所示,其晶胞边长为x pm,则HS晶体的密度为$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3(列式即可,阿伏加德罗常数用NA表示);a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$xpm(用含x的式子表示).
 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
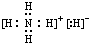 .
.(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子,该分子中σ键和π键的个数比为1:1.
(3)画出D基态原子的核外电子排布图
 .
.(4)C与A形成最简单化合物的沸点高于E与A形成的化合物,其原因是NH3分子之间可以形成氢键.
(5)EF3中心原子的杂化方式为sp3;用价层电子对互斥理论推测其空间构型为三角锥形.
(6)检验G元素的方法是焰色反应;请用原子结构的知识解释产生此现象的原因当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量.
(7)H与硫元素形成的化合物HS的晶体结构如图所示,其晶胞边长为x pm,则HS晶体的密度为$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3(列式即可,阿伏加德罗常数用NA表示);a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$xpm(用含x的式子表示).
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 标准状况下,1L液态水中含有的H+数目为10-7NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为NA/n | |
| D. | 1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为NA |
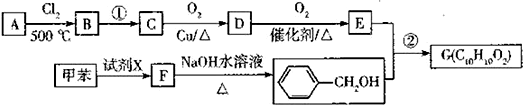
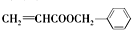 .
.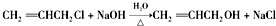 .
.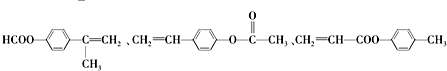 .
. .
.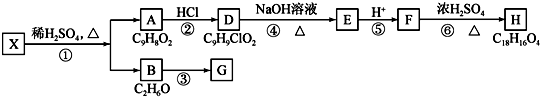
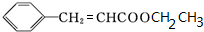 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$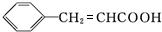 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.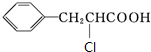 .
.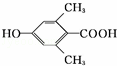 、
、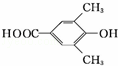 .
.