题目内容
2.X、Y、Z、W都是周期表中前20号元素.Y、W同周期,Z、W同主族;X2+与Z2-具有相同的电子层结构,Z中核外电子数是W中核内质子数的2倍;Y的同素异形体之一是地球上天然存在的硬度最大的物质.下列叙述正确的是( )| A. | 原子半径大小顺序:X>Z>W>Y | |
| B. | 氢化物的沸点高低顺序:Z>W | |
| C. | 元素非金属性强弱顺序:W>Z>Y | |
| D. | 化合物XW与XW2中化学键类型完全相同 |
分析 X、Y、Z、W都是周期表中前20号元素.由X2+与Z2-离子所带电荷可知X处于ⅡA族、Z处于ⅥA族,Z、W同主族,Z中核外电子数是W中核内质子数的2倍,则Z为S元素、W为O元素;X2+与Z2-具有相同的电子层结构,则为X为Ca;Y、W同周期,Y的同素异形体之一是地球上天然存在的硬度最大的物质,则Y为碳元素,结合元素周期律与元素化合物性质解答.
解答 解:X、Y、Z、W都是周期表中前20号元素.由X2+与Z2-离子所带电荷可知X处于ⅡA族、Z处于ⅥA族,Z、W同主族,Z中核外电子数是W中核内质子数的2倍,则Z为S元素、W为O元素;X2+与Z2-具有相同的电子层结构,则为X为Ca;Y、W同周期,Y的同素异形体之一是地球上天然存在的硬度最大的物质,则Y为碳元素.
A.原子半径大小顺序:X(Ca)>Z(S)>Y(C)>W(O),故A错误;
B.Z、W的氢化物分别为硫化氢、水,水分子之间形成氢键,沸点高于硫化氢的,故B错误;
C.同主族自上而下非金属性减弱,硫酸的酸性比碳酸的强,则元素非金属性强弱顺序:W(O)>Z(S)>Y(C),故C正确;
D.化合物CaS含有离子键、而CaO2含有离子键、共价键,故D错误.
故选:C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,注意氢键对物质性质的影响.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 标准状况下,1L液态水中含有的H+数目为10-7NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为NA/n | |
| D. | 1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为NA |
7.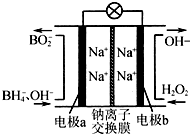 硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )
硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )
 硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )
硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )| A. | 电极a为正极,b为负极 | |
| B. | 放电时,Na+从b极区移向a极区 | |
| C. | 电极b上发生的电极反应为H2O2+2e-═2OH- | |
| D. | 每生成1 mol BO2-转移6 mol电子 |
20.卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
| A. | 卤素元素原子最外层电子数都是7 | B. | 从氟到碘,卤素原子半径依次减小 | ||
| C. | 卤素元素单质均为气态 | D. | 从氟到碘,非金属性逐渐增强 |
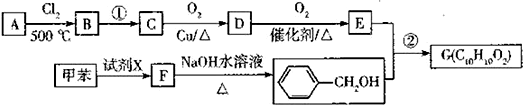
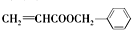 .
.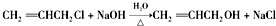 .
.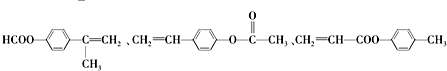 .
. .
.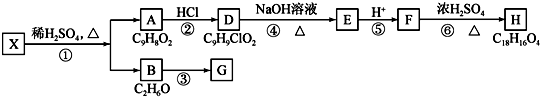
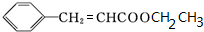 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$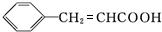 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.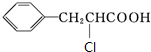 .
.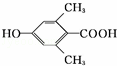 、
、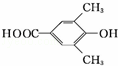 .
.