题目内容
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.其负极电极反应式是 .
(2)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),
得到如下三组数据:
①实验1中,以v(H2)表示的平均反应速率为 .
②该反应的正反应为 (填“吸”或“放”)热反应.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分别相等),则a、b应满足的关系是 (用含a、b的数学式表示).
(3)将3g碳在足量氧气中燃烧,所得气体通入100mL 3.5mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质及其物质的量分别为 和 .
(1)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.其负极电极反应式是
(2)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),
得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | 1 |
②该反应的正反应为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分别相等),则a、b应满足的关系是
(3)将3g碳在足量氧气中燃烧,所得气体通入100mL 3.5mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质及其物质的量分别为
考点:原电池和电解池的工作原理,反应热和焓变,反应速率的定量表示方法,等效平衡
专题:化学平衡专题,电化学专题
分析:(1)碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应;
(2)①利用化学反应速率的计算公式计算;
②利用转化率与消耗量和起始量的关系计算并判断反应热;
③从等效平衡的角度分析.
(3)依据二氧化碳和氢氧化钠物质的量之比,利用元素守恒即和极限法方法计算判断生成产物.
(2)①利用化学反应速率的计算公式计算;
②利用转化率与消耗量和起始量的关系计算并判断反应热;
③从等效平衡的角度分析.
(3)依据二氧化碳和氢氧化钠物质的量之比,利用元素守恒即和极限法方法计算判断生成产物.
解答:
解:(1)碱性甲烷燃料电池,具有还原性的燃料甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2))①v(CO2)=
=0.16mol/(L?min)=v(H2),故答案为:0.16mol?(L?min)-1;
②实验1中CO的转化率为
×100%=40%,实验2中CO的转化率为
×100%=20%,则实验1的转化率大于实验2,
则说明温度升高平衡向逆反应方向移动,该反应放热,故答案为:放;
③若实验3要达到与实验2等效的平衡状态,则所加入物质的物质的量之比等于初始原料的配比数,即b=2a,故答案为:b=2a;
(3)3g碳物质的量=
=0.25mol,在足量氧气中燃烧,所得气体通入100mL 3.5mol/L的氢氧化钠溶液中,氢氧化钠物质的量=0.1mol×3.5mol/L=0.35mol;n(CO2):n(NaOH)=0.25:0.35=5:7,
完全吸收后,若二氧化碳和氢氧化钠反应生成碳酸钠,CO2+2NaOH═Na2CO3+H2O,物质的量之比n(CO2):n(NaOH)=1:2,
若二氧化碳和氢氧化钠反应生成碳酸氢钠,物质的量之比n(CO2):n(NaOH)=1:1,
而1:2<5:7<1:1,所以生成的产物为碳酸钠和碳酸氢钠,设碳酸钠的物质的量是x,碳酸氢钠的物质的量是y,则根据碳元素守恒:x+y=0.25mol,根据钠元素守恒,则2x+y=0.35mol,解得x=0.1mol,y=0.15mol,所以碳酸钠的物质的量是0.1mol,碳酸氢钠的物质的量是0.15mol,
故答案为:0.15molNaHCO3;0.1molNa2CO3.
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2))①v(CO2)=
| ||
| 5min |
②实验1中CO的转化率为
| 4mol-2.4mol |
| 2mol |
| 2mol-1.6mol |
| 2mol |
则说明温度升高平衡向逆反应方向移动,该反应放热,故答案为:放;
③若实验3要达到与实验2等效的平衡状态,则所加入物质的物质的量之比等于初始原料的配比数,即b=2a,故答案为:b=2a;
(3)3g碳物质的量=
| 3g |
| 12g/mol |
完全吸收后,若二氧化碳和氢氧化钠反应生成碳酸钠,CO2+2NaOH═Na2CO3+H2O,物质的量之比n(CO2):n(NaOH)=1:2,
若二氧化碳和氢氧化钠反应生成碳酸氢钠,物质的量之比n(CO2):n(NaOH)=1:1,
而1:2<5:7<1:1,所以生成的产物为碳酸钠和碳酸氢钠,设碳酸钠的物质的量是x,碳酸氢钠的物质的量是y,则根据碳元素守恒:x+y=0.25mol,根据钠元素守恒,则2x+y=0.35mol,解得x=0.1mol,y=0.15mol,所以碳酸钠的物质的量是0.1mol,碳酸氢钠的物质的量是0.15mol,
故答案为:0.15molNaHCO3;0.1molNa2CO3.
点评:本题考查燃料电池的工作原理、化学平衡和化学反应速率、元素以及化合物的计算等知识,注意元素守恒思想的灵活应用,难度中等.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.
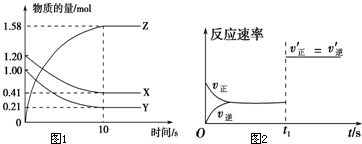 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
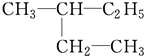 和
和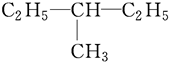
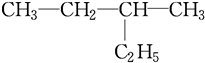 和
和