题目内容
一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量.在相同温度下,向一恒压容器中通入 1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同恒容容器中通入1molN2和3molH2,相同温度下达到平衡时放出热量为Q2kJ.则下列叙述正确的是( )
| A、Q2>Q1=92.4kJ |
| B、Q2=Q1=92.4kJ |
| C、Q2<Q1<92.4kJ |
| D、Q2=Q1<92.4kJ |
考点:化学平衡的计算
专题:
分析:热化学方程式N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol表示一定条件下,1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ.
反应为可逆反应,物质不能完全反应,恒温恒压下,1molN2和3molH2,达平衡时放出热量为Q1<92.4kJ,由于N2(g)+3H2(g)═2NH3(g)是一个气体体积减小的反应,恒温恒容时相当于在恒温恒压的平衡下将容器变大,即压强减小,平衡向逆方向移动,故放出的热量Q2少于Q1,据此判断.
反应为可逆反应,物质不能完全反应,恒温恒压下,1molN2和3molH2,达平衡时放出热量为Q1<92.4kJ,由于N2(g)+3H2(g)═2NH3(g)是一个气体体积减小的反应,恒温恒容时相当于在恒温恒压的平衡下将容器变大,即压强减小,平衡向逆方向移动,故放出的热量Q2少于Q1,据此判断.
解答:
解:热化学方程式N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol表示一定条件下,1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ.
反应为可逆反应,物质不能完全反应,恒温恒压下,1molN2和3molH2,达平衡时放出热量为Q1<92.4kJ,由于N2(g)+3H2(g)═2NH3(g)是一个气体体积减小的反应,恒温恒容时相当于在恒温恒压的平衡下将容器变大,即压强减小,平衡向逆方向移动,故放出的热量Q2少于Q1,故Q2<Q1<92.4kJ.
故选:C.
反应为可逆反应,物质不能完全反应,恒温恒压下,1molN2和3molH2,达平衡时放出热量为Q1<92.4kJ,由于N2(g)+3H2(g)═2NH3(g)是一个气体体积减小的反应,恒温恒容时相当于在恒温恒压的平衡下将容器变大,即压强减小,平衡向逆方向移动,故放出的热量Q2少于Q1,故Q2<Q1<92.4kJ.
故选:C.
点评:本题考查热化学方程式的意义、反应热的计算、可逆反应特征、难度中等,注意掌握等效平衡规律、理解热化学方程式意义.

练习册系列答案
相关题目
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
石灰石是一种化工原料,可以通过反应生成一系列物质,如图.
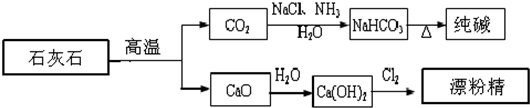
下列说法正确的是( )

下列说法正确的是( )
| A、漂粉精是混合物,主要成分是氯化钙 |
| B、图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2 |
| C、纯碱属于碱,俗名苏打 |
| D、制取纯碱和漂粉精所涉及的反应都是非氧化还原反应 |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |
常温下,AgI的溶度积是8.3×10-17,在该温度下把0.01L浓度为8.0×10-6mol/L的AgNO3溶液和0.01L浓度为4.0×10-7 mol/L的KI溶液混合,下列说法正确的是(溶液体积变化忽略不计)( )
| A、不能确定有无AgI沉淀生成 |
| B、没有AgI沉淀生成 |
| C、有KNO3晶体析出 |
| D、有AgI沉淀生成 |
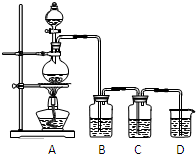 已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: