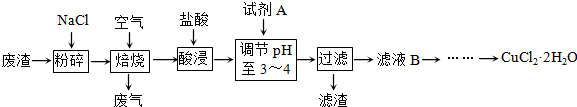
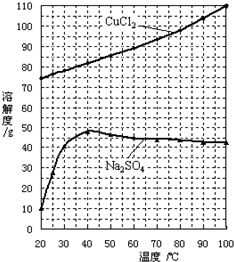
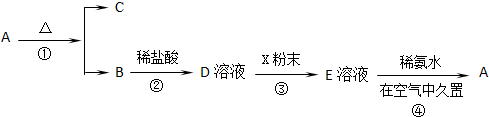
题目内容
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:生成水的物质的量为:n(H2O)=
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而碳原子数小于1.6的只有甲烷,则一定含有甲烷,然后根据平均分子式进行判断.
| 3.6g |
| 18g/mol |
解答:
解:n(H2O)=
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,混合烃的平均分子式为C1.6H4;
烃中C原子数小于1.6的只有CH4,则混合气体中一定含有CH4,由于CH4分子中含4个H原子,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是C2H4或C3H4,
A.根据以上分析可知,混合气体中一定含有CH4,故A正确;
B.混合气体中一定含有CH4,可能含有C2H4,即不一定含有乙烯,故B错误;
C.混合烃的平均分子式为:C1.6H4,烃中C原子数小于1.6的只有CH4,则一定含有CH4,CH4分子中含4个H原子,故另一种分子中一定含4个H原子,则一定没有乙炔,故C正确;
D.根据以上分析,混合气体可能含丙炔,故D错误;
故选AC.
| 3.6g |
| 18g/mol |
烃中C原子数小于1.6的只有CH4,则混合气体中一定含有CH4,由于CH4分子中含4个H原子,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是C2H4或C3H4,
A.根据以上分析可知,混合气体中一定含有CH4,故A正确;
B.混合气体中一定含有CH4,可能含有C2H4,即不一定含有乙烯,故B错误;
C.混合烃的平均分子式为:C1.6H4,烃中C原子数小于1.6的只有CH4,则一定含有CH4,CH4分子中含4个H原子,故另一种分子中一定含4个H原子,则一定没有乙炔,故C正确;
D.根据以上分析,混合气体可能含丙炔,故D错误;
故选AC.
点评:本题考查混合烃组成的判断,题目难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量.在相同温度下,向一恒压容器中通入 1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同恒容容器中通入1molN2和3molH2,相同温度下达到平衡时放出热量为Q2kJ.则下列叙述正确的是( )
| A、Q2>Q1=92.4kJ |
| B、Q2=Q1=92.4kJ |
| C、Q2<Q1<92.4kJ |
| D、Q2=Q1<92.4kJ |
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积.已知下表数据:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的下列说法,正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到的是蓝色沉淀 | ||
B、该溶液中c(S
| ||
| C、向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | ||
| D、向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
丙烯酸的结构简式为CH2=CH-COOH,对其性质的描述不正确的是( )
| A、能与金属钠反应放出氢气 |
| B、能发生加聚反应生成高分子化合物 |
| C、能与新制氢氧化铜反应 |
| D、能与溴水发生氧化反应使其褪色 |
25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5 mol/L,则CaCO3在该温度下的Ksp为( )
| A、9.3×10-5 mol/L |
| B、9.7×10-9 mol2/L2 |
| C、7.6×10-17 mol4/L4 |
| D、8.7×10-9 mol2/L2 |