题目内容
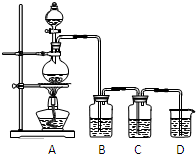 已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置A的烧瓶中发生反应的离子方程式为
(2)装置B中盛放的试剂是
(3)C中盛放的试剂是(选填下列所给试剂的代码)
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)
考点:实验装置综合,探究化学规律
专题:实验题
分析:可利用Cl2+S2-═2Cl-+S↓验证氯元素的非金属性比硫元素的非金属性强,实验时,A发生MnO2+4H++2Cl-
Mn2++Cl2+2H2O,生成的氯气经除杂后,与硫化钠发生氧化还原反应,最后用氢氧化钠溶液进行尾气的吸收,以此解答该题.
| ||
解答:
解:(1)实验室用二氧化锰和浓盐酸来制取氯气,其原理为:MnO2+4H++2Cl-
Mn2++Cl2+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2+2H2O;
(2)由于浓盐酸易挥发,所以制备的Cl2中混有HCl,故饱和食盐水是用来吸收HCl,故答案为:饱和食盐水;除去HCl;
(3)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2-═2Cl-+S↓;反应中有淡黄色沉淀生产;
故答案为:A;产生淡黄色沉淀;Cl2+S2-═2Cl-+S↓;
(4)能证明氯元素比硫元素非金属性强的依据:氯原子比硫原子更容易获得电子形成离子,得电子能力越强非金属性越强;通过最高价含氧酸的酸性可以比较非金属性;S2-比Cl-还原性强,根据阴离子的还原性越弱非金属性越强来判断;氢化物越稳定,非金属性越强,
故答案为:酸性:HClO4>H2SO4 或稳定性:HCl>H2S或H2与Cl2的反应比H2与S的反应剧烈等均可.
| ||
| ||
(2)由于浓盐酸易挥发,所以制备的Cl2中混有HCl,故饱和食盐水是用来吸收HCl,故答案为:饱和食盐水;除去HCl;
(3)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2-═2Cl-+S↓;反应中有淡黄色沉淀生产;
故答案为:A;产生淡黄色沉淀;Cl2+S2-═2Cl-+S↓;
(4)能证明氯元素比硫元素非金属性强的依据:氯原子比硫原子更容易获得电子形成离子,得电子能力越强非金属性越强;通过最高价含氧酸的酸性可以比较非金属性;S2-比Cl-还原性强,根据阴离子的还原性越弱非金属性越强来判断;氢化物越稳定,非金属性越强,
故答案为:酸性:HClO4>H2SO4 或稳定性:HCl>H2S或H2与Cl2的反应比H2与S的反应剧烈等均可.
点评:本题考查物质的性质比较,为高频考点,注意从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程.

练习册系列答案
相关题目
下列实验操作或检验正确的是( )
A、 收集氯气 |
B、 模拟石油蒸馏 |
C、 转移溶液 |
D、 用海水制少量蒸馏水 |
一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量.在相同温度下,向一恒压容器中通入 1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同恒容容器中通入1molN2和3molH2,相同温度下达到平衡时放出热量为Q2kJ.则下列叙述正确的是( )
| A、Q2>Q1=92.4kJ |
| B、Q2=Q1=92.4kJ |
| C、Q2<Q1<92.4kJ |
| D、Q2=Q1<92.4kJ |
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积.已知下表数据:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的下列说法,正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到的是蓝色沉淀 | ||
B、该溶液中c(S
| ||
| C、向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | ||
| D、向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
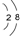
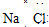
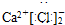
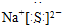
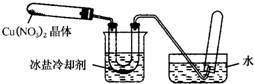 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.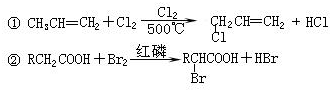
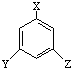 ,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有
,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有