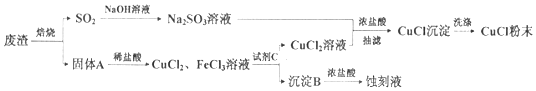
��Ŀ����
4����ij�¶�T��ʱ����N2O4��NO2�ֱ����������Ϊ1L���ܱ������У���Ӧ������Ũ�ȱ仯����[2NO2��g��?N2O4��g����H��0]��| ���� | ���� | ��ʼŨ��/��mol•L-1�� | ƽ��Ũ��/��mol•L-1�� |
| �� | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| �� | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A�� | ƽ��ʱ�����з�Ӧ��ת���ʦ���N2O4��������NO2�� | |
| B�� | ƽ���������ͬ�¶ȣ���N2O4��ʾ�ķ�Ӧ����v����v���� | |
| C�� | ƽ��ʱ����������Ӧ��ƽ�ⳣ��K����=$\frac{��}{K����}$ | |
| D�� | ƽ��������¶ȣ�����������ɫ�������� |
���� A�����ݱ���ƽ��ʱ���ݼ�����ת���ʣ�
B��������ͬ�¶�ʱ��Ũ��Խ��Ӧ����Խ�죻
C����Ӧ���ƽ�ⳣ����Ϊ������
D�������¶ȣ�ƽ�������ƶ���NO2Ũ������
��� �⣺A�����Ц���N2O4��=$\frac{0.1-0.04}{0.1}$=0.6������NO2��=$\frac{0.1-0.0716}{0.1}$=0.284���ʢ��з�Ӧ���ת���ʦ���N2O4��������NO2������A��ȷ��
B���ɱ������ݿ�֪��ƽ��ʱc��N2O4����СΪ������N2O4��ʾ�ķ�Ӧ���ʦͣ����ͣ���������ͬ�¶ȣ�Ũ��Խ��Ӧ����Խ������N2O4��ʾ�ķ�Ӧ���ʣ��ͣ����ͣ�����B����
C����������ӦΪN2O4��g��?2NO2��g������������ӦΪ2NO2��g��?N2O4��g��������ƽ�ⳣ����Ϊ��������K����=$\frac{1}{K����}$����C��ȷ��
D��2NO2��g��?N2O4��g����H��0�������¶ȣ�ƽ�������ƶ���NO2Ũ��������ɫ�����D��ȷ��
��ѡB��
���� ���⿼���˻�ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰ת���ʵļ��㡢��Ӧ���ʵ�Ӱ�����ء���ѧƽ�ⳣ������ѧƽ�⼰��Ӱ���֪ʶ������֪ʶ��϶࣬��ֿ�����ѧ���ķ�����������������ѧ����������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
12������������Ϊ98%��Ũ������ˮ���е������ϣ��õ��Ļ��Һ��������Ϊ��������
| A�� | =49% | B�� | ��49% | C�� | ��49% | D�� | ��ȷ�� |
19������aA��g��+bB��g��?cC��g����Ӧ���ı�ijһ�������������õ���ͼ��p ��ʾѹǿ��T ��ʾ�¶ȣ�n ��ʾ���ʵ������� ��ʾƽ��ת���ʣ�������ͼ�������ж���ȷ���ǣ�������
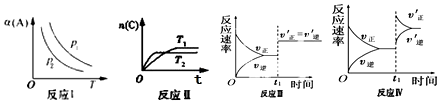

| A�� | ��Ӧ I���� p1��p2���� a+b��c | |
| B�� | ��Ӧ�˷�Ӧ�ġ�H��0���� T1��T2 | |
| C�� | ��Ӧ��ʾt1 ʱ��һ����ʹ�ô����Է�Ӧ���ʵ�Ӱ�� | |
| D�� | ��Ӧ������ʾt1ʱ������ B ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� |
16���������ǿ�ű��Чҩ������������ͼ��ʾ�л���Ҳ��������������������ȷ���ǣ�������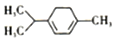

| A�� | ���������ڷ����廯���������ˮ | |
| B�� | �����ʿ��Է�����ȥ��������ȡ���ȷ�Ӧ | |
| C�� | �÷��ӽṹ������̼ԭ�ӿ��ܹ�ƽ�� | |
| D�� | ���л����һ��ȡ������7�֣���������ṹ�� |
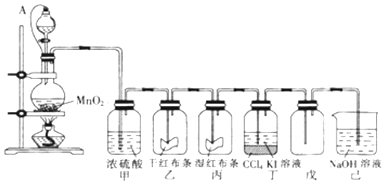
7����ijͬѧ̽���������ᷴӦ�����ʱ仯���й�ʵ�����ݼ�¼���£�
��1����Ӧ��������ʱ��Σ���0��1��1��2��2��3��3��4��4��5min����2��3��
��2�������ø�ʵ�鷴Ӧ���ʿ죬����������������������������Һ�м�������������Һ�Լ�����Ӧ���ʣ�A������ˮ��B��NaCl��Һ��C��NaNO3��Һ������Ϊ�����е���C��ԭ������NO���壬Ӱ����������������
��ijѧϰС�����������ʵ����֤Ԫ�������ɣ���a��b��c��d��ֻ�ձ���ֱ����������ˮ���ֱ�μӼ��η�̪��Һ�����μ����С�����Na��Mg��Al��K�����飬�۲�����
��3������Ԫ���Ա仯���ɣ�ͬ������ϵ�������ǿ��ͬ���ڴ�����������
��4����Ӧ����ҵ��ձ���Ľ�����d������ĸ��a����b��þc����d���أ�
��5��a�ձ������Ӧ�����ӷ���ʽ��2Na+2H2O=2Na++2OH-+H2����
��6��ʵ���з���b��c��ֻ�ձ��������������ʵ��ʵ��Ŀ�ģ��������ѡ�����к��ʵķ���BC��
A����þ�����Ľ����黻�ɽ�����ĩ
B�����ձ��е���ˮ������ˮ
C�����ձ��е���ˮ��������
D�����ձ��е���ˮ��������������Һ��
| ��Ӧʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| �������������ml�� | 50 | 150 | 300 | 380 | 410 |
��2�������ø�ʵ�鷴Ӧ���ʿ죬����������������������������Һ�м�������������Һ�Լ�����Ӧ���ʣ�A������ˮ��B��NaCl��Һ��C��NaNO3��Һ������Ϊ�����е���C��ԭ������NO���壬Ӱ����������������
��ijѧϰС�����������ʵ����֤Ԫ�������ɣ���a��b��c��d��ֻ�ձ���ֱ����������ˮ���ֱ�μӼ��η�̪��Һ�����μ����С�����Na��Mg��Al��K�����飬�۲�����
��3������Ԫ���Ա仯���ɣ�ͬ������ϵ�������ǿ��ͬ���ڴ�����������
��4����Ӧ����ҵ��ձ���Ľ�����d������ĸ��a����b��þc����d���أ�
��5��a�ձ������Ӧ�����ӷ���ʽ��2Na+2H2O=2Na++2OH-+H2����
��6��ʵ���з���b��c��ֻ�ձ��������������ʵ��ʵ��Ŀ�ģ��������ѡ�����к��ʵķ���BC��
A����þ�����Ľ����黻�ɽ�����ĩ
B�����ձ��е���ˮ������ˮ
C�����ձ��е���ˮ��������
D�����ձ��е���ˮ��������������Һ��
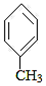 +CO$��_{��}^{AlCl_{3}��HCl}$
+CO$��_{��}^{AlCl_{3}��HCl}$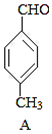 $��_{OH-����}^{CH_{3}CHO}$B$��_{��H+}^{��C}$
$��_{OH-����}^{CH_{3}CHO}$B$��_{��H+}^{��C}$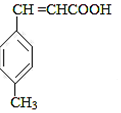 $��_{Ũ���ᣬ��}^{CH_{3}OH}$E
$��_{Ũ���ᣬ��}^{CH_{3}OH}$E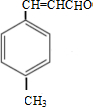 ������E�ķ�Ӧ����Ϊ������Ӧ��ȡ����Ӧ
������E�ķ�Ӧ����Ϊ������Ӧ��ȡ����Ӧ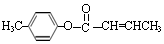 ��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ
��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ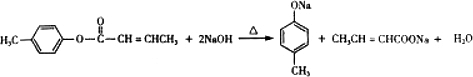 ��
��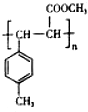 ��
��