题目内容
15.为了讲授“氯气的性质和用途”,A老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行教学.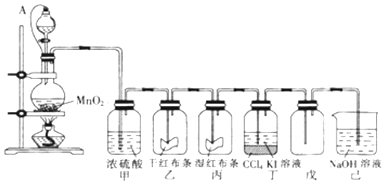
试回答下列问题:
(1)乙和丙中的现象分别是干燥的红布条不褪色、湿润的红布条褪色;
(2)分离丁中液体的方法是分液;
(3)分液漏斗与烧瓶连接橡皮管的目的是有利于球形分液漏斗里浓盐酸顺利流入烧瓶里;
(4)烧瓶内发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应 ②用87g二氧化锰与足量的浓盐酸反应,则所得氯气A
A.②比①多 B.①比②多 C.一样多 D.无法比较
(5)将产生的Cl2通入FeCl2溶液中得到含有FeCl2和FeCl3的混合物,实验测得混合物中n(Fe元素):n(Cl元素)=1:2.4,则该溶液中Fe2+和Fe3+的物质的量浓度之比约为3:2.
分析 (1)依据氯气不具有漂白性,次氯酸具有漂白性解答;
(2)氯气与碘化钾反应生成碘单质,碘易溶于四氯化碳,四氯化碳不溶于水,密度大于水;
(3)根据针头的作用判断压强的大小,气体的压强有利于分液漏斗内的液体顺利流下;
(4)二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水;浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题;
(5)设二价铁离子物质的量为x,三价铁离子的物质的量为y,依据n(Fe元素):n(Cl元素)=1:2据此计算.
解答 解:(1)氯气不具有漂白性,次氯酸具有漂白性,通入到乙中的氯气为干燥氯气,所以不能使红色布条褪色,通入丙中的氯气与湿润布条中的水反应生成据有漂白性的次氯酸,所以有色布条褪色;
故答案为:干燥的红布条不褪色; 湿润的红布条褪色;
(2)氯气与碘化钾反应生成碘单质,碘易溶于四氯化碳,四氯化碳不溶于水,密度大于水,溶于分层,所以可以用分液的方法分离;
故答案为:分液;
(3)利用针头的橡皮管连接后,分液漏斗与烧瓶内气压相等,有利于液体流下;
故答案为:有利于球形分液漏斗里浓盐酸顺利流入烧瓶里;
(4)二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
①n(HCl)=$\frac{146g}{36.5g/mol}$=4mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,
∵4HCl(浓)→Cl2
∴生成的n(Cl2)<1mol;
②n(MnO2)=$\frac{87g}{87g/mol}$=1mol,由于浓盐酸足量,
∵MnO2→Cl2
∴生成的n(Cl2)=1mol,所以所得C12②比①多,
故答案为:A
(5)设二价铁离子物质的量为x,三价铁离子的物质的量为y,则氯离子的物质的量为2x+3y,依据n(Fe元素):n(Cl元素)=1:2.4可知:(x+y):(2x+3y)=1:2.4,解得x:y=3:2,
故答案为:3:2.
点评 本题考查了氯气的制取、性质,明确氯气制备原理及氯气、次氯酸的性质是解题关键,题目难度不大.

| A. | 体积不变,向其中加入1mol H2 | |
| B. | 体积不变,向其中加入1mol N2 | |
| C. | 压强不变,向其中加入1mol N2 | |
| D. | 压强不变,向其中加入1mol H2和1molI2 |
 海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )
海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )| A. | t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2 | |
| B. | t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和 | |
| C. | t2℃时,KCl和MgSO4两种物质的溶解度相同 | |
| D. | 将卤水加热到t2℃以上,析出的晶体主要为MgSO4 |
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 油脂和蛋白质都属于高分子化合物 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
| 选项 | 结论 | 原因 |
| A | 将氯气通入H2O2和NaOH的混合溶液中,导管口处发出红光,产生大量的气泡 | 该反应是放热反应,H2O2显示氧化性 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的Ksp小 |
| C | 在BaCl2和氨水混合溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O、
+2H2O、 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O.
+H2O. .
. 制备
制备 的合成路线.
的合成路线.