题目内容
13.氯化亚铜(化学式为CuCl)常用作有机合成工业中的催化剂,是一种白色固体,微溶于水,不溶于乙醇.某实验小组用工业废渣(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液,设计流程如图: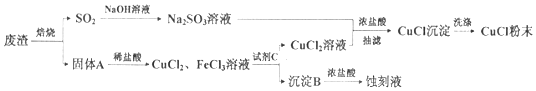
(1)为了提高固体A的溶解速率,可采用的措施是将固体A粉碎为粉末;升高温度,增大盐酸的浓度等.
(2)沉淀B为Fe(OH)3,试剂C为CuO.
(3)将Na2SO3溶液和CuCl2溶液混合均匀,再加入少量浓盐酸调节体系的pH,充分反应后倾出淸液,抽滤即得CuCl沉淀,写出该反应的离子方程式2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢,CuCl沉淀的洗涤剂应该选用乙醇以减小沉淀损失.
(4)该生产过程中对CuCl产率探究时发现:
①在隔绝空气条件下进行时CuCl产率较高,由此推测CuCl具有还原性;
②CuCl在溶液的pH较高时产率较低,试分析其可能的主要原因是pH较高时Cu2+与碱反应生成Cu(OH)2,生成CuCl较少.
分析 用工业废渣(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液,废渣焙烧硫化亚铜生成氧化铜、二氧化硫,二氧化硫通入氢氧化钠溶液吸收得到亚硫酸钠溶液,固体A主要为氧化铜和氧化铁,加入稀盐酸溶解得到氯化铁溶液和氯化铜溶液,加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到氯化铜溶液和沉淀B为氢氧化铁,亚硫酸钠溶液和氯化铜溶液加入浓盐酸抽滤得到氯化亚铜沉淀,洗涤得到固体粉末,沉淀B是氢氧化铁,溶解于浓盐酸得到蚀刻液,以此解答该题.
解答 解:(1)提高溶解速率可以增大接触面积,把A固体粉碎,升高温度、增大盐酸的浓度等措施,
故答案为:将固体A粉碎为粉末;升高温度,增大盐酸的浓度等;
(2)由以上分析可知沉淀B为Fe(OH)3,试剂C为CuO等,起到调节pH的作用,且不引入新杂质,故答案为:Fe(OH)3;CuO;
(3)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀发生氧化还原反应,反应的离子方程式为:2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢;氯化亚铜微溶于水、不溶于乙醇,可用乙醇作为洗涤剂,
故答案为:2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢;乙醇;
(4)①空气中有氧气,在隔绝空气条件下进行时CuCl产率较高,说明CuCl能被氧气氧化,即CuCl具有还原性,
故答案为:还原;
②由于pH较高时Cu2+与碱反应生成Cu(OH)2,生成CuCl较少,所以在pH值较高时,CuCl产率较低,
故答案为:pH较高时Cu2+与碱反应生成Cu(OH)2,生成CuCl较少.
点评 本题考查了物质的分离提纯实验过程分析判断,为高考常见题型和高频考点,侧重考查学生的分析、实验能力,注意把握题干信息的应用、氧化还原反应产物的分析及其离子和化合物性质的理解应用等知识点,题目难度中等.

 天天练口算系列答案
天天练口算系列答案| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 油脂和蛋白质都属于高分子化合物 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂和吸水剂;反应中加入过量的乙醇,目的是提高乙酸的转化率.
(2)仪器C的名称是球形干燥管,其作用有冷凝乙酸乙酯和防止倒吸,若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为红色变浅(或褪去)且出现分层现象.
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图:

则试剂a是:饱和Na2CO3溶液,试剂b是:硫酸.分离方法I是分液,分离方法II是蒸馏.
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功.
试解答下列问题:
①甲实验失败的原因是:所加的NaOH溶液较少,没有将余酸中和.
②乙实验失败的原因是:所加的NaOH溶液过量使酯完全水解.
| 选项 | 结论 | 原因 |
| A | 将氯气通入H2O2和NaOH的混合溶液中,导管口处发出红光,产生大量的气泡 | 该反应是放热反应,H2O2显示氧化性 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的Ksp小 |
| C | 在BaCl2和氨水混合溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
| A. | A | B. | B | C. | C | D. | D |
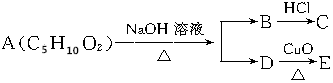
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |

 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步: