题目内容
12.将质量分数为98%的浓硫酸与水进行等体积混合,得到的混合液质量分数为( )| A. | =49% | B. | >49% | C. | <49% | D. | 不确定 |
分析 依据溶液稀释过程中含溶质的质量不变结合硫酸的密度大于水的密度,浓度越大密度越大,等体积混合后所得溶液质量小于原浓硫酸质量的2倍,再根据w(溶质)=$\frac{m(溶质)}{m(溶液)}$×100%判断.
解答 解:稀释后溶质H2SO4的质量不变,由于硫酸的密度大于水的密度,等体积混合后所得溶液质量小于原浓硫酸质量的2倍,再根据w(溶质)=$\frac{m(溶质)}{m(溶液)}$×100%可知,稀释后溶液的质量分数大于49%,
故选:B.
点评 本题考查溶液浓度有关计算,明确溶液稀释过程中溶质的质量不变,硫酸浓度越大密度越大的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
3.化学与生活密切相关.下列有关说法正确的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 油脂和蛋白质都属于高分子化合物 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
17.下列物质中,其水溶液能导电又属于非电解质的是( )
| A. | NH3 | B. | 蔗糖 | C. | 空气 | D. | 液态HC1 |
4.在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)?N2O4(g)△H<0]:
下列说法不正确的是( )
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
1.某课外小组设计的实验室制取乙酸乙酯的装置如图1:
己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
请回答:
(1)浓硫酸的作用:催化剂和吸水剂;反应中加入过量的乙醇,目的是提高乙酸的转化率.
(2)仪器C的名称是球形干燥管,其作用有冷凝乙酸乙酯和防止倒吸,若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为红色变浅(或褪去)且出现分层现象.
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图:

则试剂a是:饱和Na2CO3溶液,试剂b是:硫酸.分离方法I是分液,分离方法II是蒸馏.
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功.
试解答下列问题:
①甲实验失败的原因是:所加的NaOH溶液较少,没有将余酸中和.
②乙实验失败的原因是:所加的NaOH溶液过量使酯完全水解.
己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂和吸水剂;反应中加入过量的乙醇,目的是提高乙酸的转化率.
(2)仪器C的名称是球形干燥管,其作用有冷凝乙酸乙酯和防止倒吸,若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为红色变浅(或褪去)且出现分层现象.
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图:

则试剂a是:饱和Na2CO3溶液,试剂b是:硫酸.分离方法I是分液,分离方法II是蒸馏.
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功.
试解答下列问题:
①甲实验失败的原因是:所加的NaOH溶液较少,没有将余酸中和.
②乙实验失败的原因是:所加的NaOH溶液过量使酯完全水解.
2.有机物A可能发生如图变化,已知C、E均能发生银镜反应,则A的可能结构(不考虑立体异构)有( )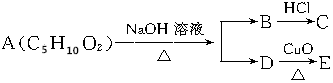
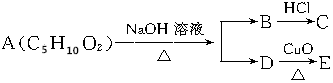
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
