题目内容
9.A、B、C、D、E均为元素周期表中短周期元素,其原子序数依次递增.请结合下表信息回答问题:| 元素 | 有关信息 |
| A | 位于第二周期第 VIA族 |
| B | 焰色反应呈黄色 |
| C | 无机非金属材料的主角 |
| D | 与A同主族 |
| E | 原子序数比D多1 |
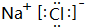 ,该化合物含有离子键(填“离子键”或“共价键”).
,该化合物含有离子键(填“离子键”或“共价键”).(2)B的单质在A的单质中燃烧的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素D、E的最高价氧化物对应的水化物的酸性HClO4 大于H2SO4(填化学式).
(4)请举出C单质的一种用途硅芯片、太阳能电池板等.
分析 A、B、C、D、E均为元素周期表中短周期元素,其原子序数依次递增,A位于第二周期第 VIA族,则A为氧元素;B的焰色反应呈黄色,则B为Na;C是无机非金属材料的主角,则C为Si;D与A同主族,则D为S元素;E的原子序数比D多1,则E为Cl.
解答 解:A、B、C、D、E均为元素周期表中短周期元素,其原子序数依次递增,A位于第二周期第 VIA族,则A为氧元素;B的焰色反应呈黄色,则B为Na;C是无机非金属材料的主角,则C为Si;D与A同主族,则D为S元素;E的原子序数比D多1,则E为Cl.
(1)元素B和E形成的化合物为NaCl,电子式为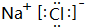 ,该化合物含有离子键,
,该化合物含有离子键,
故答案为: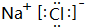 ;离子键;
;离子键;
(2)钠的单质在氧气中燃烧生成过氧化钠,化学方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(3)非金属性Cl>S,故最高价氧化物对应的水化物的酸性:HClO4>H2SO4,
故答案为:HClO4>H2SO4;
(4)硅是良好的半导体材料,制备硅芯片、太阳能电池板等,
故答案为:硅芯片、太阳能电池板等.
点评 本题考查结构性质位置关系应用,题目贴近教材,基础性强,注意对元素周期律与元素化合物知识的掌握.

练习册系列答案
相关题目
19.阿魏酸是一种广泛存在植物的酚酸,很多保健品中常含有阿魏酸,其结构简式如图:下列说法不正确的是:( )

| A. | 该化合物既可以与Br2的CCl4溶液发生加成又可以与浓溴水发生取代反应 | |
| B. | 该化合物具有还原性,能被过氧化物氧化,还能与氯化铁溶液反应 | |
| C. | 具有苯环上与阿魏酸相同取代基,又与阿魏酸互为同分异构体的化合物应有8种 | |
| D. | 阿魏酸乙酯的分子式为C12H14O4 |
20.分析表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是( )
①是己酸;②是己醇;③是戊酸甲酯;④在稀硫酸中易变质;⑤一定能与钠反应.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A. | ③④ | B. | ①③④ | C. | ②⑤ | D. | ②③⑤ |
17.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A. | X、Z、Y、W的原子半径依次减小 | |
| B. | 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y3W2 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | W与X形成的化合物只含离子键 |
4.用CH 3CH 2CH 2OH 制取聚丙烯可能遇到的反应类型有( )
| A. | 取代 | B. | 消去 | C. | 加聚 | D. | 酯化 |
14.现有部分短周期元素的性质、应用或原子结构如下表:
(1)元素X可测定文物年代的同位素符号是614C.
(2)元素Z在周期表中的位置为第三周期ⅦA族.Y单质的结构式为N≡N.
(3)元素Y与氢元素形成一种离子YH4+,实验室检验溶液中含有这种离子方法是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Z在周期表中的位置为第三周期ⅦA族.Y单质的结构式为N≡N.
(3)元素Y与氢元素形成一种离子YH4+,实验室检验溶液中含有这种离子方法是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
1.下列物质属于纯净物的是( )
| A. | 碱石灰 | B. | 正丁烷 | C. | 合金 | D. | 铝热剂 |
18.下列事实不能说明醋酸是弱酸的是( )
| A. | 室温下CH3COONa溶液的pH值大于7 | |
| B. | 同温同浓度的盐酸与CH3COOH溶液比较,醋酸溶液导电能力弱 | |
| C. | CH3COOH不与NaCl反应 | |
| D. | 室温下0.1 mol/L CH3COOH溶液的pH=2.9 |
19.A、B、C、D、E是短周期元素,A、B、C处于同一周期,A元素的原子最外层电子数是次外层的2倍,B2-、C-、D+、E3+具有相同电子层结构,下列说法正确的是( )
| A. | 原子序数:E>D>B>C>A | B. | 原子半径:D>E>A>C>B | ||
| C. | 最简单氢化物的热稳定性:C>B>A | D. | 离子半径:C->D+>E3+>B2- |