题目内容
11.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 标准状况下.11.2LNH3中含有N一H键的数目为1.5N | |
| B. | 足量的铜与含2mo1H2SO4的浓硫酸充分反应.可生成NA个SO2分子 | |
| C. | 标准状况下.将11.2LC12通人足量的石灰乳中制备漂白粉.转移的电子数为0.5NA | |
| D. | 常温常压下.21g氧气和27g臭氧所含的氧原子总数为3NA |
分析 A、求出氨气的物质的量,然后根据1mol氨气中含3molN-H键来分析;
B、铜只能与浓硫酸反应,和稀硫酸不反应;
C、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、标况下,11.2L氨气的物质的量为0.5mol,而1mol氨气中含3molN-H键,故0.5mol氨气中含1.5NA条N-H键,故A正确;
B、铜只能与浓硫酸反应,和稀硫酸不反应,故2mol浓硫酸不能完全反应,则生成的二氧化硫分子个数小于NA个,故B错误;
C、标况下11.2L氯气的物质的量为0.5mol,而氯气和碱的反应为歧化反应,1mol氯气转移1mol电子,故0.5mol氯气转移0.5NA个电子,故C正确;
D、氧气和臭氧均由氧原子构成,故21g氧气和27g臭氧的混合物中含有的氧原子的物质的量为n=$\frac{48g}{16g/mol}$=3mol,故为3NA个,故D正确.
故选B.
点评 本题考查了物质的量和阿伏伽德罗常数的有关计算,难度不大,应注意物质结构的特点和公式的运用.

练习册系列答案
相关题目
1.下列物质属于纯净物的是( )
| A. | 碱石灰 | B. | 正丁烷 | C. | 合金 | D. | 铝热剂 |
2.同主族3种元素X、Y、Z,已知它们的最高价氧化物对应水化物的酸性HXO4>HYO4>HZO4则下列判断正确的是( )
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX>HZ>HY | ||
| C. | 非金属性X>Y>Z | D. | 气态氢化物还原性HX>HY>HZ |
19.A、B、C、D、E是短周期元素,A、B、C处于同一周期,A元素的原子最外层电子数是次外层的2倍,B2-、C-、D+、E3+具有相同电子层结构,下列说法正确的是( )
| A. | 原子序数:E>D>B>C>A | B. | 原子半径:D>E>A>C>B | ||
| C. | 最简单氢化物的热稳定性:C>B>A | D. | 离子半径:C->D+>E3+>B2- |
16.将4.9g Mg和Fe的混合物在过量的稀硝酸中完全反应,得到标准状况下NO气体2.24L,向反应后的溶液中加入足量的烧碱充分反应,最后生成的沉淀的质量是( )
| A. | 8g | B. | 10g | C. | 10.2g | D. | 11.2g |
6.常温下向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示下列说法不正确的是( )


| A. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L | |
| B. | 在b点,c (Na+)═c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c (CH3COO-)>c (H+ )>c (Na+)>c (OH-) | |
| D. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
3.某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:下列有关判断正确的是( )
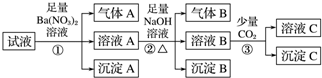

| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |